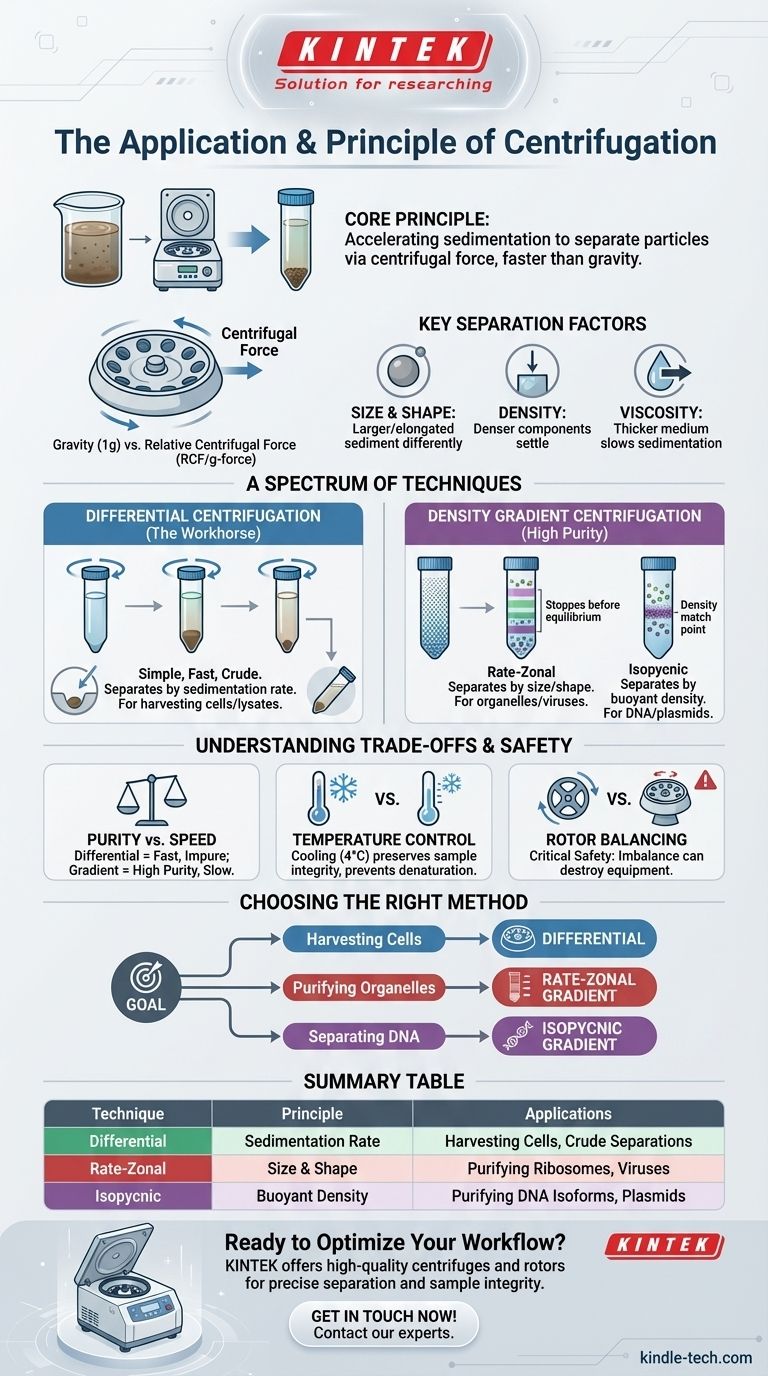
À la base, la centrifugation est une technique qui utilise la force centrifuge pour séparer les particules d'une solution. Le principe fondamental est d'accélérer le processus naturel de sédimentation, où les composants plus denses se déposent d'un mélange au fil du temps. En faisant tourner les échantillons à grande vitesse, une centrifugeuse génère une force puissante qui peut séparer les composants en fonction de leur taille, de leur forme et de leur densité en une fraction du temps que la gravité nécessiterait.
La véritable puissance de la centrifugation ne réside pas dans la simple rotation des échantillons, mais dans l'application précise de la force pour exploiter les subtiles différences physiques entre les particules, permettant leur isolement sélectif d'un mélange complexe.
Le principe fondamental : exploiter la sédimentation
La centrifugation est une pierre angulaire de la biologie, de la chimie et de la médecine modernes car elle offre un moyen fiable de purifier et de concentrer les composants d'un échantillon liquide. Comprendre la physique qui la sous-tend est essentiel pour l'utiliser efficacement.
De la gravité à la force G
Imaginez un verre d'eau boueuse. Au fil du temps, les particules de sable et de limon plus denses se déposeront lentement au fond en raison de la gravité. Une centrifugeuse accélère radicalement ce processus.
En faisant tourner les échantillons dans un rotor, la machine crée une force centrifuge qui agit vers l'extérieur, loin du centre de rotation. Cette force pousse les particules plus denses et plus grandes vers le fond du tube beaucoup plus rapidement que la gravité seule, formant un culot compact.
Qu'est-ce que la Force Centrifuge Relative (FCR) ?
La vitesse du rotor est souvent décrite en tours par minute (RPM), mais cette métrique est incomplète. La force de séparation réelle dépend du rayon du rotor de la centrifugeuse.
La véritable mesure de la force appliquée est la Force Centrifuge Relative (FCR), également connue sous le nom de force g. La FCR standardise la force entre différentes machines et rotors, ce qui en fait le paramètre critique pour tout protocole de centrifugation. Elle représente combien de fois la force centrifuge est plus forte que la force gravitationnelle de la Terre.
Les facteurs clés influençant la séparation
Le mouvement d'une particule dans un champ centrifuge est déterminé par quatre propriétés principales :
- Taille et forme : Les particules plus grandes ou plus allongées subissent plus de traînée et sédimentent différemment des petites particules sphériques.
- Densité : Une particule plus dense que le liquide environnant (le milieu) sédimentera et se déplacera vers le fond du tube. Une particule moins dense flottera.
- Viscosité du milieu : Un liquide plus épais et plus visqueux créera plus de friction, ralentissant le taux de sédimentation pour toutes les particules.
Un éventail de techniques pour diverses applications
Toutes les centrifugations ne sont pas identiques. La méthode est choisie en fonction des composants à séparer et du niveau de pureté requis.
Centrifugation différentielle : la méthode de base
C'est la technique la plus simple et la plus courante. Elle implique de soumettre un échantillon à une série de cycles de centrifugation à des vitesses progressivement plus élevées.
Après chaque centrifugation, le matériau déposé (culot) est séparé du liquide restant (surnageant). Le surnageant est ensuite centrifugé à nouveau à une FCR plus élevée pour culoter les composants suivants, plus petits et moins denses. Ceci est souvent utilisé pour des séparations grossières, comme l'isolement de cellules intactes du milieu de culture ou la séparation des principaux organites cellulaires.
Centrifugation en gradient de densité : pour les séparations de haute pureté
Pour des séparations plus raffinées où les composants ont des tailles similaires, un gradient de densité est utilisé. Cela implique de créer une solution dans le tube de la centrifugeuse qui augmente progressivement en densité de haut en bas, souvent en utilisant du saccharose ou du chlorure de césium (CsCl).
Lorsque l'échantillon est centrifugé à travers ce gradient, les particules migrent jusqu'à ce qu'elles atteignent un point où leur densité correspond à celle du milieu environnant, ou elles sont séparées en bandes distinctes en fonction de leur vitesse de sédimentation.
Séparation zonale en gradient de vitesse vs. isopycnique
La centrifugation en gradient de densité a deux modes principaux :
- Zonale en gradient de vitesse : Les particules sont séparées principalement en fonction de leur taille et de leur forme (leur vitesse de sédimentation). La centrifugation est arrêtée avant que les particules n'atteignent leur point d'équilibre de densité. C'est idéal pour séparer des particules de densité similaire mais de tailles différentes, comme les ribosomes et les polysomes.
- Isopycnique : Les particules sont séparées uniquement en fonction de leur densité de flottation. La centrifugation est suffisamment longue pour que chaque particule migre vers un point du gradient où sa densité est égale à la densité du milieu du gradient. À ce point, elle cesse de bouger. Cette méthode puissante peut séparer des macromolécules comme différentes isoformes d'ADN.
Comprendre les compromis
Le choix d'une méthode de centrifugation nécessite d'équilibrer la vitesse, la pureté et l'intégrité de l'échantillon.
Pureté vs. Contamination
La centrifugation différentielle est rapide et simple, mais elle produit souvent des culots impurs. Parce que le seul facteur est la sédimentation, des particules plus petites qui commencent près du fond du tube peuvent être co-culotées avec des particules plus grandes, entraînant une contamination croisée.
La centrifugation en gradient de densité offre une pureté bien plus élevée en séparant les particules en bandes distinctes. Cependant, elle est beaucoup plus longue et techniquement plus complexe à préparer et à exécuter les gradients.
Le rôle critique du contrôle de la température
Le frottement d'un rotor tournant à grande vitesse génère une chaleur importante. Pour les échantillons biologiques comme les protéines ou les acides nucléiques, cette chaleur peut provoquer une dénaturation, détruisant leur structure et leur fonction.
Par conséquent, la plupart des centrifugeuses à grande vitesse (ultracentrifugeuses) sont réfrigérées pour maintenir une température constante et fraîche (généralement 4°C) tout au long de la centrifugation, préservant ainsi l'intégrité de l'échantillon.
Le piège le plus courant : un rotor déséquilibré
La pratique de sécurité la plus critique est l'équilibrage de la centrifugeuse. Les tubes placés dans le rotor doivent être équilibrés avec un autre tube de masse identique directement opposé.
Une charge déséquilibrée à grande vitesse crée d'énormes vibrations et un couple qui peuvent détruire le rotor et la centrifugeuse elle-même, posant un grave danger pour la sécurité. Même un léger déséquilibre peut causer des dommages au fil du temps et entraîner une séparation sous-optimale.
Choisir la bonne méthode de centrifugation
Votre choix de technique doit être dicté par votre objectif analytique final.
- Si votre objectif principal est de récolter des cellules ou de collecter un lysat brut : La centrifugation différentielle est la méthode la plus rapide et la plus efficace.
- Si votre objectif principal est de purifier des organites ou des virus spécifiques : La centrifugation zonale en gradient de densité fournira la résolution nécessaire pour séparer les composants par taille.
- Si votre objectif principal est de séparer des molécules avec des densités de flottation différentes, comme les plasmides de l'ADN chromosomique : La centrifugation isopycnique en gradient de densité est la référence pour obtenir la plus haute pureté.
En comprenant ces principes, vous transformez la centrifugeuse d'un simple appareil de rotation en un outil précis et puissant pour la purification et l'analyse.
Tableau récapitulatif :
| Technique de centrifugation | Principe primaire | Applications courantes |
|---|---|---|
| Centrifugation différentielle | Vitesse de sédimentation à des vitesses croissantes | Récolte de cellules, séparation grossière d'organites |
| Zonale en gradient de vitesse (gradient de densité) | Séparation par taille et forme | Purification de ribosomes, virus, organites |
| Isopycnique (gradient de densité) | Séparation par densité de flottation | Purification d'isoformes d'ADN, plasmides |
Prêt à optimiser le flux de travail de centrifugation de votre laboratoire ?
KINTEK est spécialisé dans la fourniture d'équipements et de consommables de laboratoire de haute qualité, y compris des centrifugeuses et des rotors fiables conçus pour une séparation précise et l'intégrité des échantillons. Que vous ayez besoin d'équipement pour la centrifugation différentielle ou des séparations en gradient de densité de haute pureté, nos solutions sont conçues pour répondre aux besoins exigeants des laboratoires modernes.
Contactez-nous dès aujourd'hui pour discuter de la manière dont nos équipements de centrifugation peuvent améliorer vos processus de recherche et de purification. Laissez nos experts vous aider à sélectionner l'outil parfait pour votre application.
Contactez-nous dès maintenant !
Guide Visuel
Produits associés
- Instrument de tamisage électromagnétique tridimensionnel
- Petite machine de moulage par injection pour laboratoire
- Presse hydraulique manuelle chauffante avec plaques chauffantes pour presse à chaud de laboratoire
- Presse Thermique Automatique de Laboratoire
- Presse hydraulique chauffante avec plaques chauffantes manuelles intégrées pour utilisation en laboratoire
Les gens demandent aussi
- Quelles sont les applications de la machine de tamisage ? De l'exploitation minière aux produits pharmaceutiques
- Quelle est la procédure de fonctionnement d'un tamis vibrant ? Maîtrisez l'analyse précise de la granulométrie
- Que fait un tamis vibrant ? Automatisez l'analyse granulométrique pour des résultats précis
- Quel est l'usage du tamis vibrant ? Obtenez une analyse précise de la granulométrie pour votre laboratoire
- Quels sont les composants d'une machine de tamisage ? Découvrez l'anatomie de la séparation de particules de précision



















