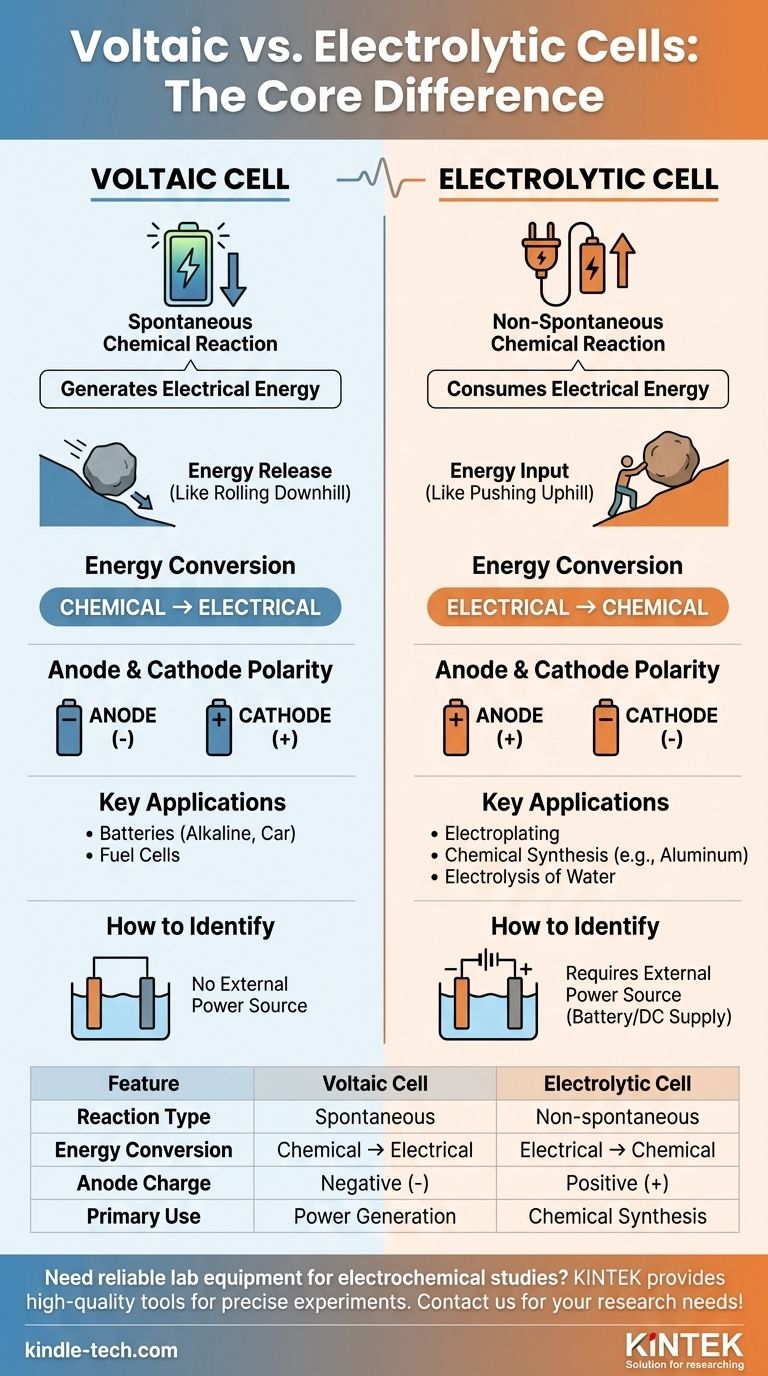
La principale différence entre une pile voltaïque et une cellule électrolytique réside dans leur objectif fondamental et la nature des réactions chimiques impliquées. Une pile voltaïque, comme une batterie courante, utilise une réaction chimique spontanée pour générer de l'énergie électrique. En revanche, une cellule électrolytique utilise de l'énergie électrique externe pour piloter une réaction chimique qui ne se produirait pas d'elle-même.
Au fond, la distinction concerne le flux d'énergie. Une pile voltaïque est une source d'énergie qui libère de l'énergie d'une réaction chimique "volontaire". Une cellule électrolytique est un consommateur d'énergie qui force une réaction chimique "non volontaire" à se produire.

Le principe fondamental : la spontanéité
Le concept le plus important qui sépare ces deux cellules est de savoir si la réaction chimique est spontanée ou non spontanée. Cela dicte toute la fonction et la structure de la cellule.
Piles voltaïques : libération spontanée d'énergie
Dans une pile voltaïque (également appelée pile galvanique), la réaction redox est spontanée. Les réactifs ont une énergie potentielle chimique plus élevée que les produits.
Cette tendance naturelle à réagir libère de l'énergie, qui est exploitée sous forme de courant électrique. Imaginez un rocher dévalant une colline – cela se produit sans aucune poussée externe.
Le potentiel de cellule standard (E°cell) pour une pile voltaïque est toujours positif, indiquant une réaction spontanée.
Cellules électrolytiques : changement chimique forcé
Dans une cellule électrolytique, la réaction redox est non spontanée. Les produits sont dans un état énergétique plus élevé que les réactifs.
Pour que cette réaction se produise, une source d'alimentation externe (comme une batterie ou une alimentation CC) doit être appliquée. C'est comme pousser le rocher vers le haut – cela nécessite un apport constant d'énergie.
Le potentiel de cellule standard (E°cell) pour la réaction dans une cellule électrolytique est négatif, confirmant qu'elle ne se produira pas sans aide externe.
Différences fonctionnelles et structurelles clés
La différence de spontanéité entraîne plusieurs distinctions cruciales dans la façon dont ces cellules sont construites et comment elles fonctionnent.
Conversion d'énergie
Une pile voltaïque effectue la conversion de l'énergie chimique en énergie électrique. C'est un générateur d'énergie chimique.
Une cellule électrolytique fait exactement le contraire. Elle convertit l'énergie électrique en énergie chimique, utilisant l'énergie pour créer de nouvelles substances.
Polarité de l'anode et de la cathode
C'est un point de confusion fréquent, mais c'est simple si vous vous souvenez des définitions de base. Dans les deux types de cellules, l'oxydation se produit toujours à l'anode et la réduction se produit toujours à la cathode.
Cependant, la charge de ces électrodes est inversée :
- Dans une pile voltaïque, l'anode est la source d'électrons de la réaction spontanée, ce qui en fait la borne négative (-). La cathode est l'endroit où les électrons sont consommés, ce qui en fait la borne positive (+).
- Dans une cellule électrolytique, la source d'alimentation externe dicte la charge. Elle pousse les électrons vers la cathode, ce qui en fait la borne négative (-). Elle retire les électrons de l'anode, ce qui en fait la borne positive (+).
Applications pratiques
Les applications de chaque type de cellule reflètent directement leur fonction.
Les piles voltaïques sont utilisées pour alimenter des appareils. Les exemples incluent les piles alcalines courantes, les batteries de voiture (lorsqu'elles se déchargent) et les piles à combustible.
Les cellules électrolytiques sont utilisées pour la synthèse et la purification. Les applications courantes incluent la galvanoplastie des métaux, la production d'aluminium pur et l'électrolyse de l'eau pour générer de l'hydrogène et de l'oxygène gazeux.
Pièges courants et distinctions clés
Pour éviter les erreurs courantes, concentrez-vous sur l'objectif de la cellule et la présence d'une source d'alimentation externe.
Objectif : Puissance vs. Production
La façon la plus simple de les distinguer est par leur but. La cellule produit-elle de l'électricité, ou utilise-t-elle de l'électricité pour produire un produit chimique ? Le premier est voltaïque ; le second est électrolytique.
Le rôle du pont salin
Les piles voltaïques se composent souvent de deux demi-cellules séparées connectées par un pont salin. Ce composant est crucial pour maintenir la neutralité de charge lorsque les ions circulent pendant la réaction spontanée.
Les cellules électrolytiques sont généralement de construction plus simple, se déroulant souvent dans un seul récipient où l'électrolyte lui-même permet le mouvement des ions.
L'alimentation électrique externe
L'indicateur visuel le plus clair dans un diagramme est la présence d'une batterie ou d'une alimentation électrique. Si vous en voyez une connectée aux électrodes, vous regardez une cellule électrolytique. Son absence implique une pile voltaïque.
Faire le bon choix pour votre objectif
Pour identifier le type de cellule ou comprendre sa fonction, considérez l'objectif principal du système.
- Si votre objectif principal est d'alimenter un appareil : Vous travaillez avec une pile voltaïque, qui exploite une réaction chimique spontanée pour produire un courant.
- Si votre objectif principal est de produire une substance pure (comme du chlore gazeux ou du cuivre métallique) : Vous utilisez une cellule électrolytique, qui pilote une réaction non spontanée avec une source d'alimentation externe.
- Si vous analysez un diagramme avec une batterie externe : Cela signifie une cellule électrolytique, car elle fournit l'énergie nécessaire pour forcer le changement chimique.
Comprendre cette division fondamentale entre la génération spontanée et la réaction forcée est la clé pour maîtriser l'électrochimie.
Tableau récapitulatif :
| Caractéristique | Pile voltaïque | Cellule électrolytique |
|---|---|---|
| Type de réaction | Spontanée | Non spontanée (nécessite une alimentation externe) |
| Conversion d'énergie | Chimique → Électrique | Électrique → Chimique |
| Charge de l'anode | Négative (-) | Positive (+) |
| Utilisation principale | Production d'énergie (ex. batteries) | Synthèse chimique (ex. galvanoplastie) |
Besoin d'équipement de laboratoire fiable pour vos études électrochimiques ? KINTEK est spécialisé dans l'équipement de laboratoire et les consommables de haute qualité, fournissant les outils précis dont vous avez besoin pour les expériences impliquant des piles voltaïques et des cellules électrolytiques. Des électrodes aux alimentations électriques, nos solutions contribuent à garantir des résultats précis et reproductibles dans votre laboratoire. Contactez-nous dès aujourd'hui pour trouver l'équipement parfait pour vos besoins de recherche !
Guide Visuel
Produits associés
- Cellule électrochimique électrolytique pour l'évaluation des revêtements
- Cellule électrochimique électrolytique à cinq ports
- Cellule de diffusion de gaz électrolytique électrochimique à flux liquide
- Bain-marie électrochimique multifonctionnel pour cellule électrolytique, simple ou double couche
- Équipement de laboratoire de batterie Testeur complet de capacité et de batterie
Les gens demandent aussi
- Quels indicateurs de performance sont mesurés à l'aide d'une cellule électrolytique à trois électrodes ? Évaluez les photocatalyseurs avec KINTEK
- Quelle est la fonction principale d'une cellule électrolytique dans la préparation d'alliages Fe-W ? Maîtriser la précision de la électrodéposition
- Comment doit-on stocker une cellule électrolytique entièrement en PTFE après utilisation ? Conseils d'experts pour une maintenance durable
- Quelle est la bonne façon de manipuler une cellule électrolytique à bain-marie à cinq orifices ? Assurer des expériences électrochimiques précises et sûres
- Comment nettoyer une cellule électrolytique entièrement en PTFE avant utilisation ? Protocole d'expert pour des résultats électrochimiques purs
- Quelle est la règle concernant la charge électrique sur la cellule électrolytique et son alimentation électrique ? Lignes directrices essentielles en matière de sécurité et de performance
- Pourquoi un système de cellule électrochimique à trois électrodes à température constante est-il utilisé dans la déposition électrolytique du manganèse ?
- Quels contrôles doivent être effectués sur la cellule électrolytique de type H avant utilisation ? Assurer des données électrochimiques précises














