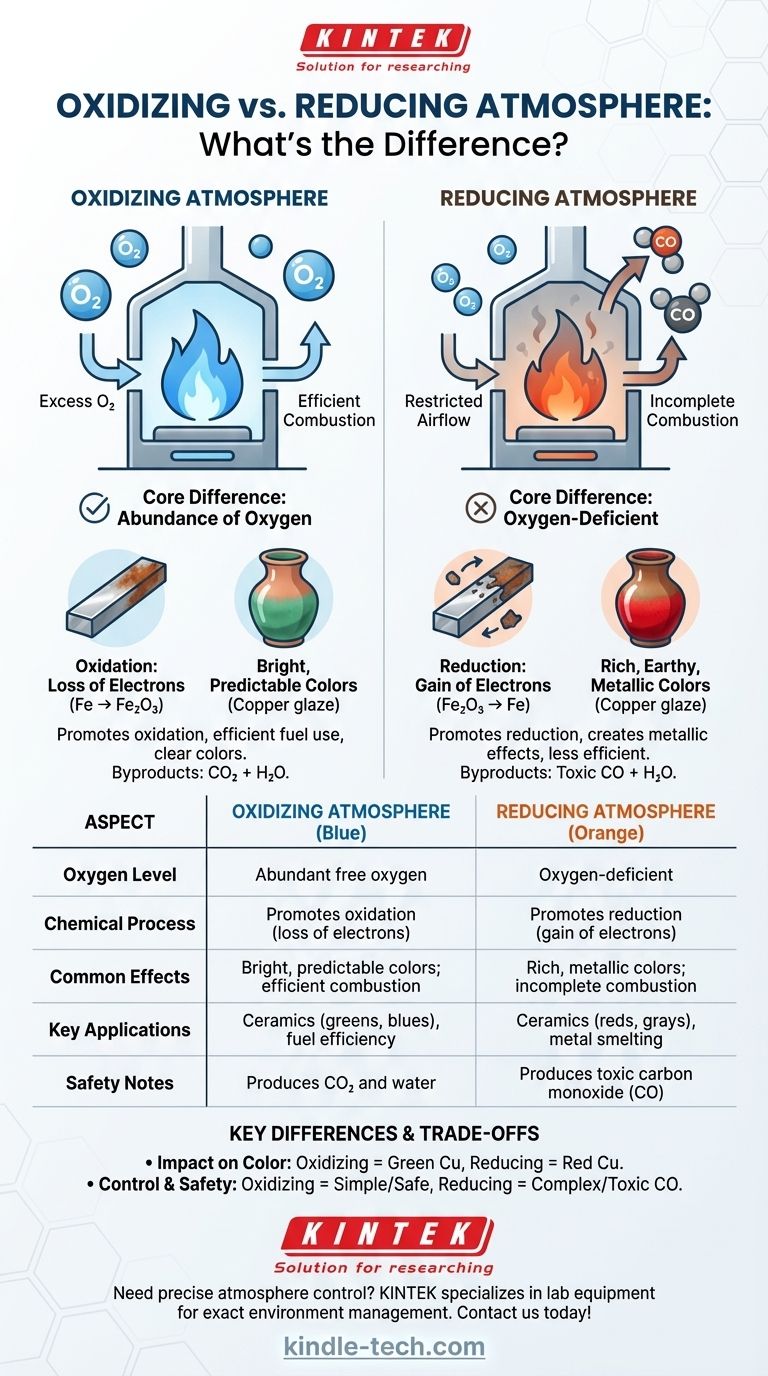
Essentiellement, la différence entre une atmosphère oxydante et une atmosphère réductrice réside dans la disponibilité de l'oxygène. Une atmosphère oxydante contient une abondance d'oxygène libre, ce qui favorise les réactions chimiques comme la combustion et la corrosion. Une atmosphère réductrice est déficiente en oxygène et arrache activement les atomes d'oxygène des matériaux, inversant le processus d'oxydation.
Le choix entre une atmosphère oxydante ou réductrice est un mécanisme de contrôle fondamental en science des matériaux et en chimie. Il ne s'agit pas seulement de l'environnement ; c'est un outil utilisé pour modifier délibérément l'état chimique et les propriétés physiques d'un matériau.
Qu'est-ce qu'une atmosphère oxydante ?
Une atmosphère oxydante est l'état "par défaut" dans lequel nous vivons, défini par la présence d'un excès d'oxygène. Dans les applications à haute température comme les fours ou les étuves, elle est maintenue en assurant un apport constant et suffisant d'air frais.
Le rôle de l'excès d'oxygène
La caractéristique clé est qu'il y a plus d'oxygène disponible que nécessaire pour brûler complètement tout combustible présent. Ce surplus d'oxygène est chimiquement actif et prêt à réagir avec d'autres matériaux.
Le processus chimique : l'oxydation
L'oxydation est une réaction chimique où une substance perd des électrons. Bien que d'autres éléments puissent en être la cause, dans ce contexte, elle implique presque toujours une liaison de la substance avec l'oxygène. C'est le même processus fondamental qui fait rouiller le fer ou brûler un feu proprement.
Effets et applications courants
Dans un feu oxydant, le combustible brûle efficacement et complètement, produisant un maximum de chaleur avec peu ou pas de suie. En céramique, il donne des couleurs claires, vives et souvent prévisibles aux glaçures et aux pâtes (par exemple, le fer produisant des tons beiges et rouges, le cuivre produisant des verts et des bleus).
Qu'est-ce qu'une atmosphère réductrice ?
Une atmosphère réductrice est un environnement pauvre en oxygène. Elle est délibérément créée dans un four ou une étuve en limitant l'apport d'air ou en introduisant plus de combustible que l'air disponible ne peut en brûler.
Le rôle du combustible non brûlé
Avec un apport insuffisant d'oxygène pour une combustion complète, le combustible non brûlé libère des composés comme le monoxyde de carbone (CO) et l'hydrogène. Ces composés sont chimiquement instables et recherchent agressivement les atomes d'oxygène pour s'y lier.
Le processus chimique : la réduction
La réduction est l'opposé de l'oxydation ; c'est une réaction chimique où une substance gagne des électrons. Dans cet environnement, le monoxyde de carbone "vole" activement les atomes d'oxygène des oxydes métalliques présents dans l'argile ou les glaçures, les réduisant à un état plus métallique.
Effets et applications courants
Un feu réducteur est souvent plus froid et plus fumant, signe d'une combustion incomplète. Il est essentiel pour des processus comme la fusion du métal à partir du minerai. En céramique, il crée des couleurs terreuses et métalliques riches, complexes et souvent imprévisibles (par exemple, le fer produisant des bleus profonds et des gris, le cuivre produisant des rouges vifs).
Comprendre les principales différences et compromis
La décision d'utiliser une atmosphère plutôt qu'une autre est entièrement dictée par le résultat souhaité, mais elle s'accompagne de compromis importants.
Impact sur la couleur et les propriétés des matériaux
C'est la différence la plus visible. Une glaçure contenant de l'oxyde de cuivre deviendra verte dans une atmosphère oxydante. La même glaçure, cuite dans une atmosphère réductrice, verra son oxygène arraché, réduisant le cuivre à sa forme métallique et créant un rouge éclatant.
Contrôle et efficacité
Obtenir une atmosphère oxydante est simple : fournir beaucoup d'air. Créer une atmosphère réductrice nécessite une gestion active, comme fermer un registre pour priver le feu d'oxygène. Cela rend le processus moins économe en carburant, car vous n'extrayez pas toute l'énergie potentielle de votre combustible.
Sécurité et sous-produits
Les feux oxydants produisent principalement du dioxyde de carbone (CO₂) et de l'eau. Les feux réducteurs, en raison d'une combustion incomplète, produisent des quantités importantes de monoxyde de carbone (CO), un gaz incolore, inodore et hautement toxique. Une ventilation adéquate est absolument essentielle lors de la création d'une atmosphère réductrice.
Comment choisir la bonne atmosphère
Votre choix dépend entièrement de votre matériau et de votre objectif. L'atmosphère n'est pas une condition de fond ; c'est un ingrédient actif dans le processus chimique.
- Si votre objectif principal est d'obtenir des couleurs vives et stables et une bonne efficacité énergétique : Utilisez une atmosphère oxydante en assurant un flux d'air constant et suffisant vers votre four ou votre étuve.
- Si votre objectif principal est d'obtenir des effets riches, terreux ou métalliques en céramique : Utilisez une atmosphère réductrice en limitant soigneusement le flux d'air à des températures spécifiques pour forcer la réduction chimique des oxydes métalliques.
- Si votre objectif principal est de fondre du minerai ou de prévenir la formation de calamine sur l'acier : Utilisez une atmosphère fortement réductrice pour arracher l'oxygène du minerai ou l'empêcher de se former à la surface du métal.
Maîtriser l'interaction entre l'oxygène et la chaleur vous donne un contrôle précis sur la forme et la fonction finales de votre matériau.

Tableau récapitulatif :
| Aspect | Atmosphère oxydante | Atmosphère réductrice |
|---|---|---|
| Niveau d'oxygène | Oxygène libre abondant | Déficiente en oxygène |
| Processus chimique | Favorise l'oxydation (perte d'électrons) | Favorise la réduction (gain d'électrons) |
| Effets courants | Couleurs vives et prévisibles ; combustion efficace | Couleurs riches et métalliques ; combustion incomplète |
| Applications clés | Céramique (verts, bleus), efficacité énergétique | Céramique (rouges, gris), fusion de métaux |
| Notes de sécurité | Produit du CO₂ et de l'eau | Produit du monoxyde de carbone (CO) toxique |
Besoin d'un contrôle précis de l'atmosphère pour vos processus de laboratoire ? KINTEK est spécialisé dans les équipements et consommables de laboratoire, proposant des fours et des étuves qui offrent un contrôle exact des environnements oxydants ou réducteurs. Que vous développiez de nouveaux matériaux, testiez des céramiques ou meniez des expériences à haute température, nos solutions garantissent des résultats précis et reproductibles. Contactez-nous dès aujourd'hui pour discuter de la manière dont nous pouvons améliorer les capacités de votre laboratoire !
Guide Visuel
Produits associés
- Four à atmosphère contrôlée 1200℃ Four à atmosphère inerte d'azote
- Four à atmosphère d'hydrogène contrôlée à l'azote
- Four à atmosphère contrôlée de 1400℃ avec atmosphère d'azote et inerte
- Four à atmosphère contrôlée 1700℃ Four à atmosphère inerte d'azote
- Four rotatif à tubes multiples zones chauffantes divisées
Les gens demandent aussi
- L'azote peut-il être utilisé pour le brasage ? Conditions clés et applications expliquées
- Qu'est-ce qu'une atmosphère inerte ? Un guide pour prévenir les incendies et les explosions
- Qu'est-ce qui fournit une atmosphère inerte ? Atteignez la sécurité et la pureté avec l'azote, l'argon ou le CO2
- Pourquoi l'azote est-il utilisé dans les fours de recuit ? Pour prévenir l'oxydation et la décarburation afin d'obtenir une qualité de métal supérieure
- Quels gaz sont utilisés dans les atmosphères inertes ? Choisissez le bon gaz pour les environnements non réactifs



















