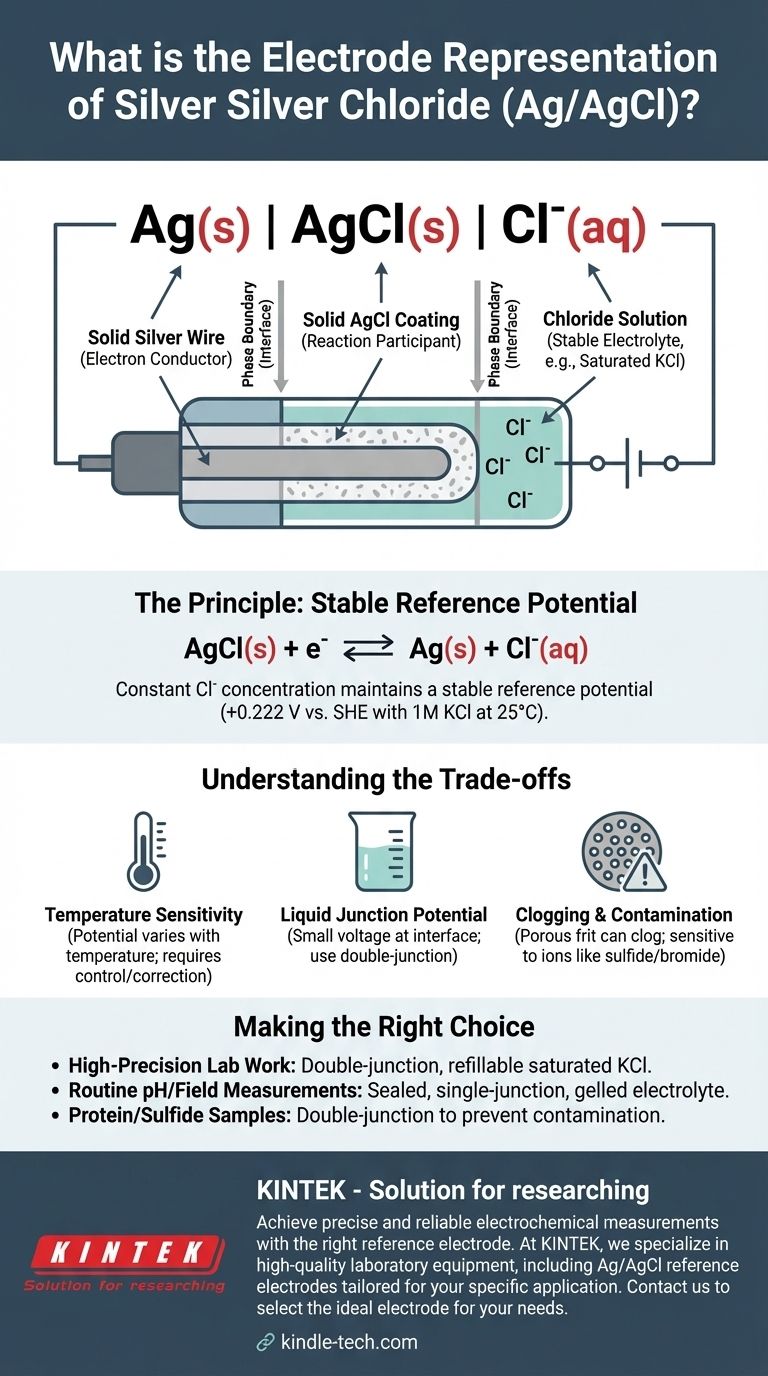
La représentation abrégée standard pour une électrode argent-chlorure d'argent est Ag(s) | AgCl(s) | Cl⁻(aq). Cette notation électrochimique décrit les phases physiques et chimiques de l'électrode, du fil d'argent métallique solide à la solution aqueuse contenant des ions chlorure. Le potentiel spécifique de l'électrode dépend de manière critique de la concentration de ces ions chlorure.
Cette notation est plus qu'une étiquette technique ; c'est un schéma pour l'une des électrodes de référence les plus fiables et les plus courantes en électrochimie. Elle décrit un système conçu pour maintenir un potentiel constant et stable, fournissant une ligne de base fixe par rapport à laquelle les potentiels d'autres électrodes peuvent être mesurés avec précision.

Déconstruction de la notation de l'électrode
La représentation Ag(s) | AgCl(s) | Cl⁻(aq) détaille la structure de l'électrode de l'intérieur vers l'extérieur. Chaque composant et symbole a une signification précise.
La phase solide : Ag(s)
Ceci représente un fil d'argent solide. Ce fil sert de conducteur d'électrons, connectant l'électrode au circuit de mesure externe (un voltmètre ou un potentiostat).
La limite de phase : |
La simple barre verticale | signifie une limite de phase. Elle indique l'interface où deux états physiques différents se rencontrent, dans ce cas, l'argent métallique solide et la couche de chlorure d'argent solide.
La couche de sel insoluble : AgCl(s)
Ceci désigne une couche de chlorure d'argent solide, peu soluble, qui est directement déposée sur la surface du fil d'argent. Cette couche est le cœur de la fonction de l'électrode, participant directement à la réaction électrochimique.
La deuxième limite de phase : |
Une deuxième barre verticale marque la limite entre le revêtement de chlorure d'argent solide et la solution électrolytique aqueuse environnante.
La solution électrolytique : Cl⁻(aq)
Ceci représente la solution aqueuse dans laquelle le fil revêtu est immergé. Cette solution doit contenir une concentration connue et constante d'ions chlorure (Cl⁻). Généralement, une solution de chlorure de potassium (KCl) est utilisée, souvent à une concentration spécifique comme 1 M ou, le plus souvent, une solution saturée.
Le principe d'une électrode de référence
L'électrode Ag/AgCl est appréciée non pas pour sa propre réaction, mais pour sa stabilité. Elle fournit une tension constante qui agit comme un point zéro fiable pour d'autres mesures.
La réaction de régulation
Le potentiel stable est établi par un équilibre réversible entre les composants solides et les ions chlorure en solution. La demi-réaction est :
AgCl(s) + e⁻ ⇌ Ag(s) + Cl⁻(aq)
Tant que la concentration (plus précisément, l'activité) des ions chlorure en solution reste constante, le potentiel de cette demi-cellule ne changera pas.
L'importance d'une concentration constante en chlorure
L'utilisation d'une solution saturée de KCl garantit que la concentration de Cl⁻ est constante et reproductible. Si de l'eau s'évapore, plus de sel KCl se dissout simplement pour maintenir la saturation. C'est pourquoi le potentiel de référence est si stable. Pour une solution de KCl 1M à 25°C (298 K), ce potentiel est de +0,222 V par rapport à l'électrode standard à hydrogène (ESH).
Comprendre les compromis
Bien que très fiable, l'électrode Ag/AgCl n'est pas sans limitations qui nécessitent une considération pour un travail précis.
Sensibilité à la température
Le potentiel de l'électrode est fonction de la température. Pour des mesures très précises, la température de la cellule doit être contrôlée ou les potentiels mesurés doivent être corrigés des variations de température.
Potentiel de jonction liquide
Lorsque la solution de KCl de l'électrode entre en contact avec une solution échantillon différente, une petite tension appelée potentiel de jonction liquide peut se développer à l'interface. Cela introduit une petite erreur systématique dans la mesure, qui peut être minimisée en utilisant une électrode à double jonction.
Colmatage et contamination
La fritte poreuse qui permet le contact électrique entre la solution interne et l'échantillon peut se colmater. Elle peut également être contaminée par des ions présents dans l'échantillon (comme le sulfure, le bromure ou l'iodure) qui peuvent réagir avec l'argent, provoquant une dérive du potentiel de l'électrode au fil du temps.
Faire le bon choix pour votre mesure
Votre application dicte la meilleure configuration d'électrode.
- Si votre objectif principal est un travail de laboratoire de haute précision : Utilisez une électrode Ag/AgCl à double jonction avec une solution de KCl saturée et rechargeable pour minimiser le potentiel de jonction et faciliter l'entretien.
- Si votre objectif principal est la mesure de pH ou les mesures sur le terrain de routine : Une électrode scellée à jonction simple avec un électrolyte gélifié est durable, nécessite peu d'entretien et est parfaitement adéquate.
- Si votre objectif principal est l'analyse d'échantillons contenant des protéines ou des sulfures : Vous devez utiliser une électrode à double jonction pour éviter le colmatage et la contamination de la jonction de référence primaire.
Comprendre cette notation la transforme d'une étiquette cryptique en un schéma fonctionnel pour une mesure électrochimique fiable.
Tableau récapitulatif :
| Composant | Symbole | Description |
|---|---|---|
| Fil d'argent solide | Ag(s) | Conducteur se connectant au circuit externe. |
| Revêtement de chlorure d'argent | AgCl(s) | Couche de sel insoluble permettant la réaction réversible. |
| Solution d'ions chlorure | Cl⁻(aq) | Électrolyte aqueux (par exemple, KCl) avec une concentration constante de Cl⁻. |
| Limite de phase |
Obtenez des mesures électrochimiques précises et fiables avec la bonne électrode de référence.
Chez KINTEK, nous sommes spécialisés dans les équipements de laboratoire de haute qualité, y compris une gamme d'électrodes de référence Ag/AgCl adaptées à votre application spécifique — que vous ayez besoin de modèles à double jonction de haute précision pour un travail de laboratoire sensible ou d'options durables et nécessitant peu d'entretien pour une analyse de routine.
Nos experts peuvent vous aider à sélectionner l'électrode idéale pour garantir un potentiel stable, minimiser les erreurs et améliorer la précision de votre recherche.
Contactez KINTEK dès aujourd'hui pour discuter de vos besoins en laboratoire et découvrir comment nos consommables et équipements fiables peuvent soutenir votre travail.
Guide Visuel
Produits associés
- Électrode de référence au calomel, chlorure d'argent, sulfate de mercure pour usage en laboratoire
- Électrode électrochimique à disque métallique
- Électrode à disque de platine rotatif pour applications électrochimiques
- Électrode à disque d'or
- Électrode à disque rotatif (disque-anneau) RRDE / Compatible avec PINE, ALS japonais, Metrohm suisse carbone vitreux platine
Les gens demandent aussi
- Pourquoi l'électrode au calomel est-elle utilisée comme électrode de référence secondaire ? Un guide pratique pour des mesures stables
- Pourquoi une électrode à calomel saturée (ECS) est-elle utilisée comme électrode de référence dans la recherche sur les piles à combustible microbiennes ?
- Quelle est l'électrode de référence pour le sulfate de mercure/sulfate mercureux ? Un guide pour l'électrochimie sans chlorure
- Quelles sont les caractéristiques d'une électrode au calomel saturée pour les solutions neutres ? Comprendre sa stabilité et ses limites.
- Quelles sont les précautions générales à prendre lors de l'utilisation d'une électrode de référence ? Assurer des potentiels stables pour des données précises



















