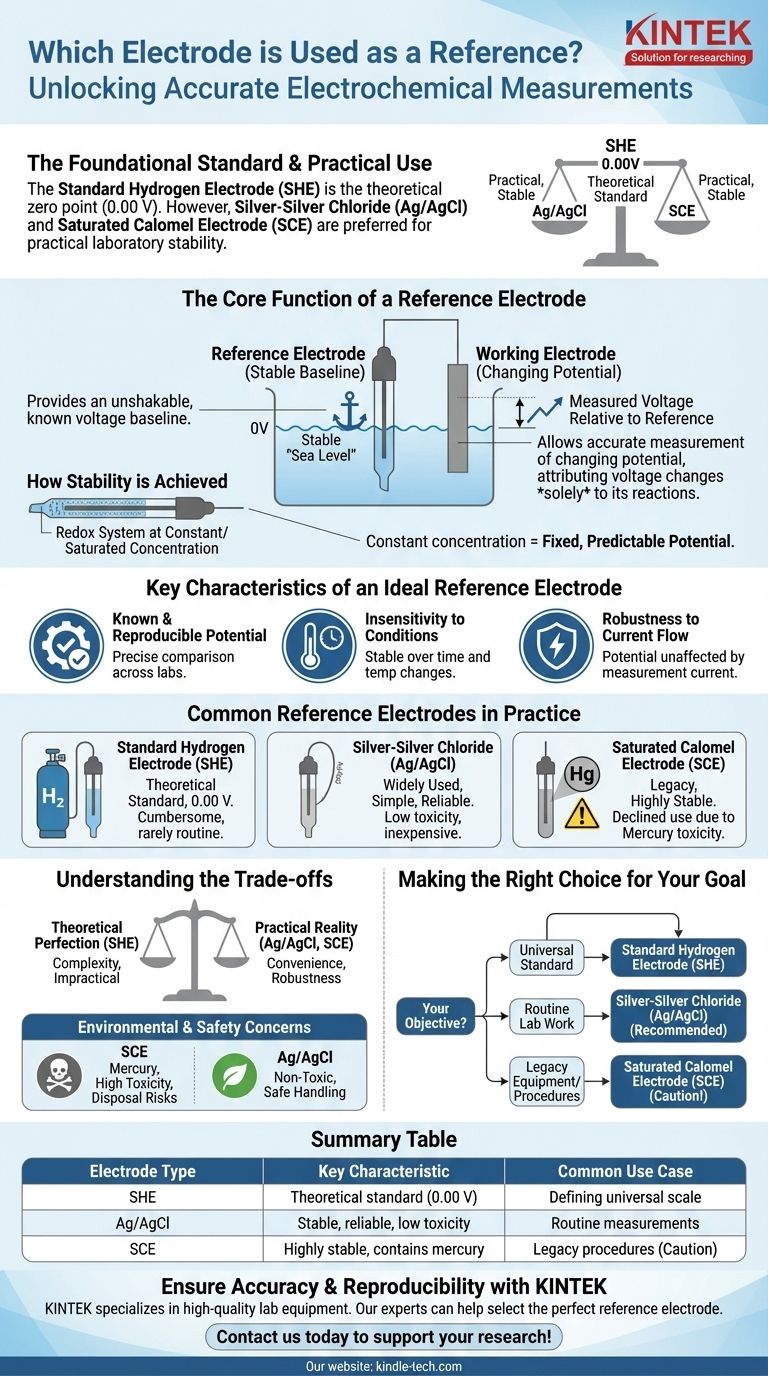
En électrochimie, l'électrode de référence fondamentale est l'électrode normale à hydrogène (ENH). Par convention universelle, son potentiel est défini comme étant exactement de 0,00 volt à toutes les températures. Cependant, pour les applications pratiques en laboratoire, des électrodes comme l'argent-chlorure d'argent (Ag/AgCl) et l'électrode au calomel saturée (ECS) sont beaucoup plus courantes en raison de leur facilité d'utilisation et de leurs performances stables.
Le but principal d'une électrode de référence n'est pas de participer à la réaction principale de votre expérience, mais de fournir une base de tension inébranlable et connue. Elle agit comme un "point zéro" stable, vous permettant de mesurer avec précision le potentiel changeant de l'électrode que vous étudiez réellement.

La fonction principale d'une électrode de référence
Une électrode de référence est un composant fondamental de presque toute configuration de mesure électrochimique. Son rôle est de fournir un point fixe par rapport auquel le potentiel d'une autre électrode peut être déterminé de manière fiable.
Établir une base stable
Une électrode de référence a un potentiel d'électrode stable et bien connu. Considérez-la comme le "niveau de la mer" pour le potentiel électrique dans un système chimique.
Vous mesurez la "hauteur", ou le potentiel, de votre électrode de travail par rapport à ce point de référence fixe et immuable.
Permettre de se concentrer sur l'électrode de travail
En maintenant un potentiel constant, l'électrode de référence garantit que toutes les variations de tension mesurées dans le système peuvent être attribuées uniquement aux réactions chimiques se produisant à l'électrode de travail.
Cela isole le phénomène que vous souhaitez étudier, éliminant tout doute quant à la fluctuation de votre point de référence.
Comment la stabilité est-elle atteinte ?
Cette grande stabilité est obtenue en utilisant un système redox où les composants sont maintenus à une concentration constante, généralement saturée.
Étant donné que les concentrations des espèces réactives à l'intérieur de l'électrode ne changent pas, le potentiel qu'elle produit reste fixe et prévisible.
Caractéristiques clés d'une électrode de référence idéale
Bien qu'il existe plusieurs types d'électrodes de référence, elles partagent toutes quelques caractéristiques essentielles qui les rendent efficaces.
Potentiel connu et reproductible
Le potentiel de l'électrode doit être précisément connu et facilement reproductible. Cela permet aux scientifiques de différents laboratoires de comparer leurs résultats de manière significative.
Insensibilité aux conditions
Le potentiel d'une électrode de référence idéale doit rester stable dans le temps et avec des changements modérés de température.
Robustesse au flux de courant
L'électrode doit être "bien équilibrée", ce qui signifie que son potentiel n'est pas affecté par la faible quantité de courant qui doit la traverser pour qu'une mesure soit effectuée. Cela garantit que l'acte de mesurer n'altère pas le résultat.
Électrodes de référence courantes en pratique
Bien que l'ENH soit la norme théorique, d'autres électrodes sont utilisées pour le travail quotidien en raison de considérations pratiques.
L'électrode normale à hydrogène (ENH)
L'ENH est la norme absolue par rapport à laquelle tous les autres potentiels d'électrode sont mesurés. C'est le point zéro formel de l'échelle électrochimique.
Malgré son importance, elle est encombrante et rarement utilisée dans les expériences de routine car elle nécessite un apport constant d'hydrogène gazeux pur et une surface de platine spécialement préparée.
Argent-chlorure d'argent (Ag/AgCl)
C'est l'une des électrodes de référence les plus utilisées aujourd'hui. Elle est appréciée pour sa simplicité, son faible coût et sa fiabilité.
Sa faible toxicité lui confère un avantage significatif sur les électrodes plus anciennes à base de mercure.
Électrode au calomel saturée (ECS)
L'ECS est une autre électrode de référence classique, très stable, qui était autrefois extrêmement courante.
Son utilisation a considérablement diminué en raison du fait qu'elle contient du mercure, un métal lourd toxique, ce qui rend sa manipulation et son élimination problématiques.
Comprendre les compromis
Le choix d'une électrode de référence implique d'équilibrer la perfection théorique et la réalité pratique.
La norme vs la pratique
L'ENH fournit la base théorique de l'électrochimie, mais sa complexité la rend peu pratique pour la plupart des applications. Les électrodes comme Ag/AgCl offrent une excellente stabilité dans un ensemble beaucoup plus pratique et robuste.
Préoccupations environnementales et de sécurité
La principale raison du passage de l'électrode au calomel saturée (ECS) à l'électrode argent-chlorure d'argent (Ag/AgCl) est la sécurité. La toxicité élevée du mercure dans l'ECS présente des risques de manipulation et d'élimination importants qui sont absents avec l'électrode Ag/AgCl.
Faire le bon choix pour votre objectif
Votre choix d'électrode de référence dépend entièrement de votre objectif, en équilibrant le besoin d'une norme universelle et les exigences pratiques du laboratoire.
- Si votre objectif principal est d'établir une norme universelle : L'électrode normale à hydrogène (ENH) est le point zéro définitif par rapport auquel tous les autres potentiels sont mesurés.
- Si votre objectif principal est le travail de laboratoire de routine : L'électrode argent-chlorure d'argent (Ag/AgCl) est le choix le plus courant en raison de sa stabilité, de son faible coût et de sa nature non toxique.
- Si vous utilisez un équipement ancien ou des procédures établies spécifiques : Vous pouvez rencontrer l'électrode au calomel saturée (ECS), mais vous devez rester conscient de sa teneur en mercure.
En fin de compte, la sélection de l'électrode de référence correcte est la première étape pour garantir que vos mesures électrochimiques sont à la fois précises et reproductibles.
Tableau récapitulatif :
| Type d'électrode | Caractéristique clé | Cas d'utilisation courant |
|---|---|---|
| Électrode normale à hydrogène (ENH) | Norme théorique (0,00 V) | Définition de l'échelle de potentiel universelle |
| Argent-chlorure d'argent (Ag/AgCl) | Stable, fiable, faible toxicité | Mesures de laboratoire de routine |
| Calomel saturée (ECS) | Très stable, contient du mercure | Procédures héritées (à utiliser avec prudence) |
Assurez l'exactitude et la reproductibilité de vos expériences électrochimiques avec la bonne électrode de référence. KINTEK est spécialisé dans les équipements et consommables de laboratoire de haute qualité, offrant des solutions fiables pour tous vos besoins en laboratoire. Nos experts peuvent vous aider à sélectionner l'électrode de référence parfaite pour votre application spécifique. Contactez-nous dès aujourd'hui pour discuter de la façon dont nous pouvons soutenir votre recherche !
Guide Visuel
Produits associés
- Électrode de référence au calomel, chlorure d'argent, sulfate de mercure pour usage en laboratoire
- Électrode électrochimique à disque métallique
- Électrode de référence au sulfate de cuivre pour usage en laboratoire
- Électrode électrochimique en carbone vitreux
- Électrode électrochimique en graphite, tige et plaque de graphite
Les gens demandent aussi
- Quel type d'électrode peut être utilisé comme point de référence ? Sélectionnez la bonne pour des mesures précises
- Pourquoi une électrode à calomel saturée (ECS) est-elle utilisée comme électrode de référence dans la recherche sur les piles à combustible microbiennes ?
- Quels sont les quatre principaux types de capteurs ? Un guide sur la source d'alimentation et le type de signal
- Quelle est l'électrode de référence pour le mercure-chlorure de mercure ? Découvrez l'électrode au calomel saturé (ECS)
- Quelles sont les caractéristiques d'une électrode au calomel saturée pour les solutions neutres ? Comprendre sa stabilité et ses limites.



















