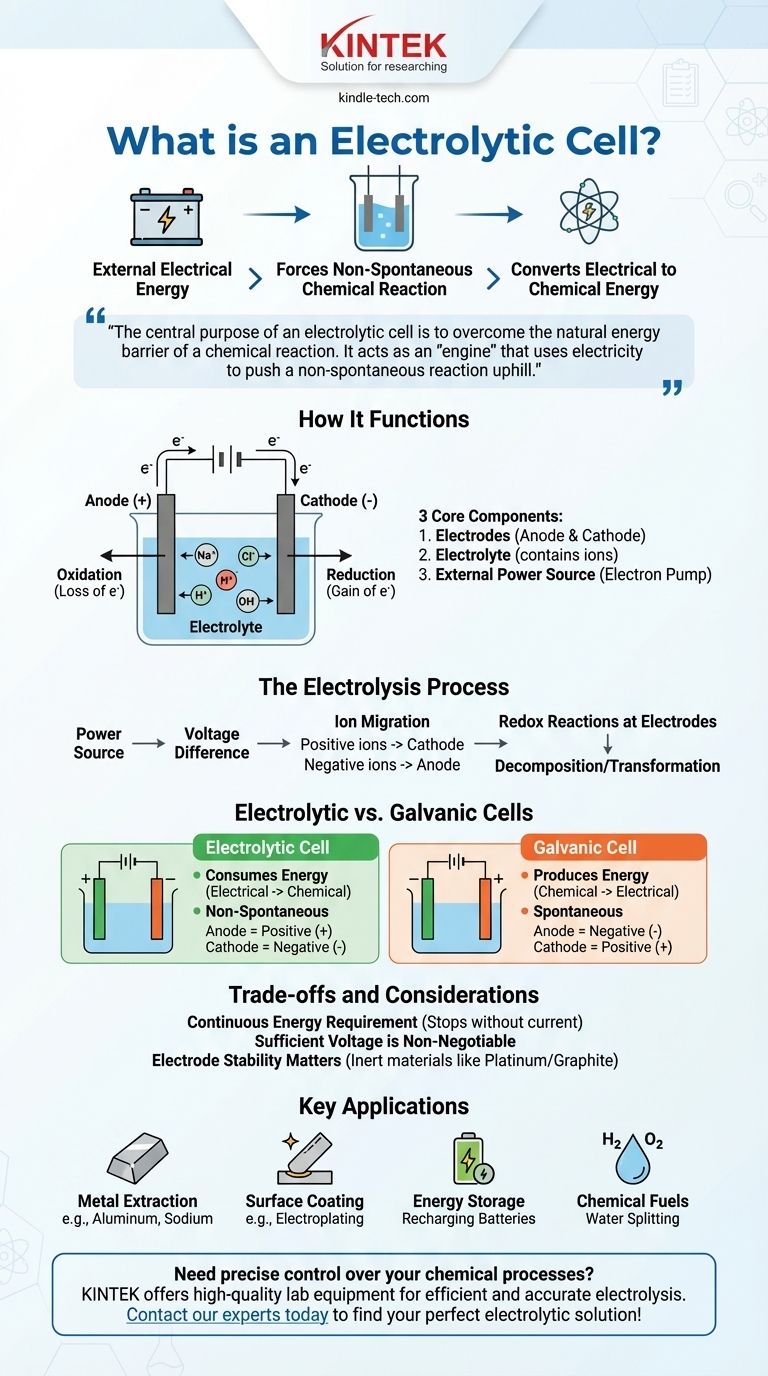
Essentiellement, une cellule électrolytique est un dispositif qui utilise l'énergie électrique provenant d'une source externe, comme une batterie, pour forcer une réaction chimique qui ne se produirait pas d'elle-même. Ce processus, connu sous le nom d'électrolyse, convertit l'énergie électrique en énergie chimique stockée en décomposant des composés tels que l'eau ou les sels fondus.
L'objectif central d'une cellule électrolytique est de surmonter la barrière énergétique naturelle d'une réaction chimique. Elle agit comme un « moteur » qui utilise l'électricité pour pousser une réaction non spontanée à contre-courant, accomplissant des tâches telles que la séparation d'éléments ou la recharge d'une batterie.

Comment fonctionne une cellule électrolytique
Pour comprendre une cellule électrolytique, nous devons examiner ses composants essentiels et le processus qu'ils permettent. L'ensemble du système est conçu pour contrôler le flux d'électrons et d'ions afin de provoquer un changement chimique spécifique.
Les trois composants principaux
Une cellule électrolytique est constituée de trois parties principales.
-
Électrodes (Anode et Cathode) : Ce sont deux conducteurs métalliques ou électroniques qui servent de sites pour la réaction chimique. L'anode est l'électrode positive où se produit l'oxydation (perte d'électrons), et la cathode est l'électrode négative où se produit la réduction (gain d'électrons).
-
Électrolyte : C'est une substance, généralement une solution liquide ou un sel fondu, qui contient des ions libres. L'électrolyte permet à la charge de circuler entre les deux électrodes, complétant ainsi le circuit électrique.
-
Source d'alimentation externe : C'est un composant crucial, comme une batterie ou une alimentation en courant continu. Elle agit comme une « pompe à électrons », retirant les électrons de l'anode et les poussant vers la cathode.
Le processus d'électrolyse
La source d'alimentation crée une différence de tension aux bornes des électrodes.
Cela force les ions présents dans l'électrolyte à migrer. Les ions chargés positivement se dirigent vers la cathode négative, et les ions chargés négativement se dirigent vers l'anode positive.
Aux électrodes, des réactions d'oxydoréduction (transfert de charge) se produisent. À l'anode, les substances perdent des électrons, et à la cathode, les substances gagnent des électrons, ce qui entraîne la décomposition ou la transformation des composants de l'électrolyte.
La distinction cruciale : Cellules électrolytiques contre cellules galvaniques
Un point de confusion fréquent est la différence entre une cellule électrolytique et son homologue, la cellule galvanique (ou voltaïque), que nous considérons généralement comme une batterie standard.
Conversion d'énergie
Une cellule électrolytique consomme de l'énergie. Elle convertit l'énergie électrique en énergie chimique.
Une cellule galvanique produit de l'énergie. Elle convertit l'énergie chimique stockée en énergie électrique.
Spontanéité de la réaction
La réaction dans une cellule électrolytique est non spontanée. Elle nécessite un apport d'énergie externe pour se produire.
La réaction dans une cellule galvanique est spontanée. Elle se produit naturellement, libérant de l'énergie au cours du processus.
Polarité des électrodes
Dans une cellule électrolytique, l'anode est positive et la cathode est négative. C'est parce que la source d'alimentation externe dicte la charge.
Dans une cellule galvanique, l'anode est négative et la cathode est positive. La réaction chimique spontanée détermine elle-même la charge.
Comprendre les compromis et les considérations
Bien que puissantes, les cellules électrolytiques fonctionnent selon des contraintes spécifiques qu'il est important de reconnaître.
Un besoin continu en énergie
La principale caractéristique d'une cellule électrolytique est sa dépendance à une source d'alimentation externe. Le processus d'électrolyse s'arrête dès que le courant électrique est coupé.
Une tension suffisante est non négociable
La tension externe appliquée doit être suffisamment élevée pour surmonter la résistance naturelle de la réaction non spontanée. Si la tension est trop faible, aucun changement chimique ne se produira.
La stabilité des électrodes est importante
Les électrodes elles-mêmes doivent être choisies avec soin. Dans de nombreux processus, elles sont fabriquées à partir de matériaux inertes comme le platine ou le graphite qui facilitent la réaction sans être consommés. Dans d'autres applications, le matériau de l'électrode est intentionnellement choisi pour participer à la réaction, comme on le voit dans certains types de purification.
Applications clés des cellules électrolytiques
La capacité de forcer des réactions chimiques confère aux cellules électrolytiques un rôle central dans l'industrie et la technologie.
- Si votre objectif principal est de produire des éléments purs : L'électrolyse est utilisée pour extraire des métaux comme l'aluminium de son minerai (bauxite) ou pour produire du sodium et du chlore gazeux à partir de chlorure de sodium fondu.
- Si votre objectif principal est le revêtement de surface : Le processus de galvanoplastie utilise une cellule électrolytique pour déposer une fine couche d'un métal (comme le chrome ou l'or) sur un autre à des fins de protection ou de décoration.
- Si votre objectif principal est le stockage d'énergie : La recharge d'une batterie implique de la faire fonctionner comme une cellule électrolytique. Le chargeur externe force les ions à retrouver leur état d'origine, stockant ainsi l'énergie pour une utilisation ultérieure.
- Si votre objectif principal est la création de carburants chimiques : Les cellules électrolytiques peuvent séparer l'eau (H₂O) en hydrogène gazeux et en oxygène gazeux, l'hydrogène servant de source de carburant propre.
En appliquant l'énergie électrique avec précision, une cellule électrolytique nous donne un contrôle direct sur les transformations chimiques.
Tableau récapitulatif :
| Caractéristique | Cellule électrolytique | Cellule galvanique (Batterie) |
|---|---|---|
| Conversion d'énergie | Convertit l'énergie électrique en énergie chimique | Convertit l'énergie chimique en énergie électrique |
| Type de réaction | Non spontanée (nécessite une alimentation externe) | Spontanée (se produit naturellement) |
| Charge de l'anode | Positive | Négative |
| Fonction principale | Pilotage des réactions chimiques souhaitées (ex. galvanoplastie) | Production d'électricité |
Besoin d'un contrôle précis de vos processus chimiques ? L'équipement de laboratoire de haute qualité de KINTEK, y compris les alimentations fiables et les électrodes durables, est essentiel pour une électrolyse efficace et précise. Que votre application concerne la galvanoplastie, la purification des métaux ou la recherche sur le stockage d'énergie, nos consommables et instruments sont conçus pour des performances supérieures. Contactez nos experts dès aujourd'hui pour trouver la solution électrolytique parfaite pour les besoins de votre laboratoire !
Guide Visuel
Produits associés
- Cellule électrochimique électrolytique à cinq ports
- Cellule électrolytique de type H Triple Cellule électrochimique
- Cellule électrochimique électrolytique pour l'évaluation des revêtements
- Cellule électrolytique optique à double couche de type H avec bain-marie
- Bain-marie électrolytique à cinq ports à double couche
Les gens demandent aussi
- Comment les composants d'un système de cellule électrolytique à trois électrodes sont-ils utilisés ? Optimiser les tests de division de l'eau PEC
- Quelle est l'application de la méthode d'électrodéposition ? De la protection de surface à la fabrication à l'échelle nanométrique
- Pourquoi un régulateur de pression de haute précision est-il nécessaire pour les CDE ? Maîtriser l'interface triphasée pour des données fiables
- Quels types d'électrodes sont utilisés dans la cellule électrolytique de type H ? Guide expert sur les systèmes à trois électrodes
- Quelles inspections régulières sont requises pour une cellule électrolytique à bain-marie à cinq ports ? Assurer des résultats électrochimiques cohérents
- Qu'est-ce que la méthode d'électrodéposition pour les nanomatériaux ? Un guide de la nanofabrication de précision
- Quelles sont les tailles d'ouverture standard sur le couvercle de la cellule électrolytique multifonctionnelle ? Ports clés pour votre configuration électrochimique
- Quelle est la procédure appropriée pour le nettoyage post-expérimental et le stockage d'une cellule électrolytique entièrement en quartz ? Assurer la longévité et la reproductibilité



















