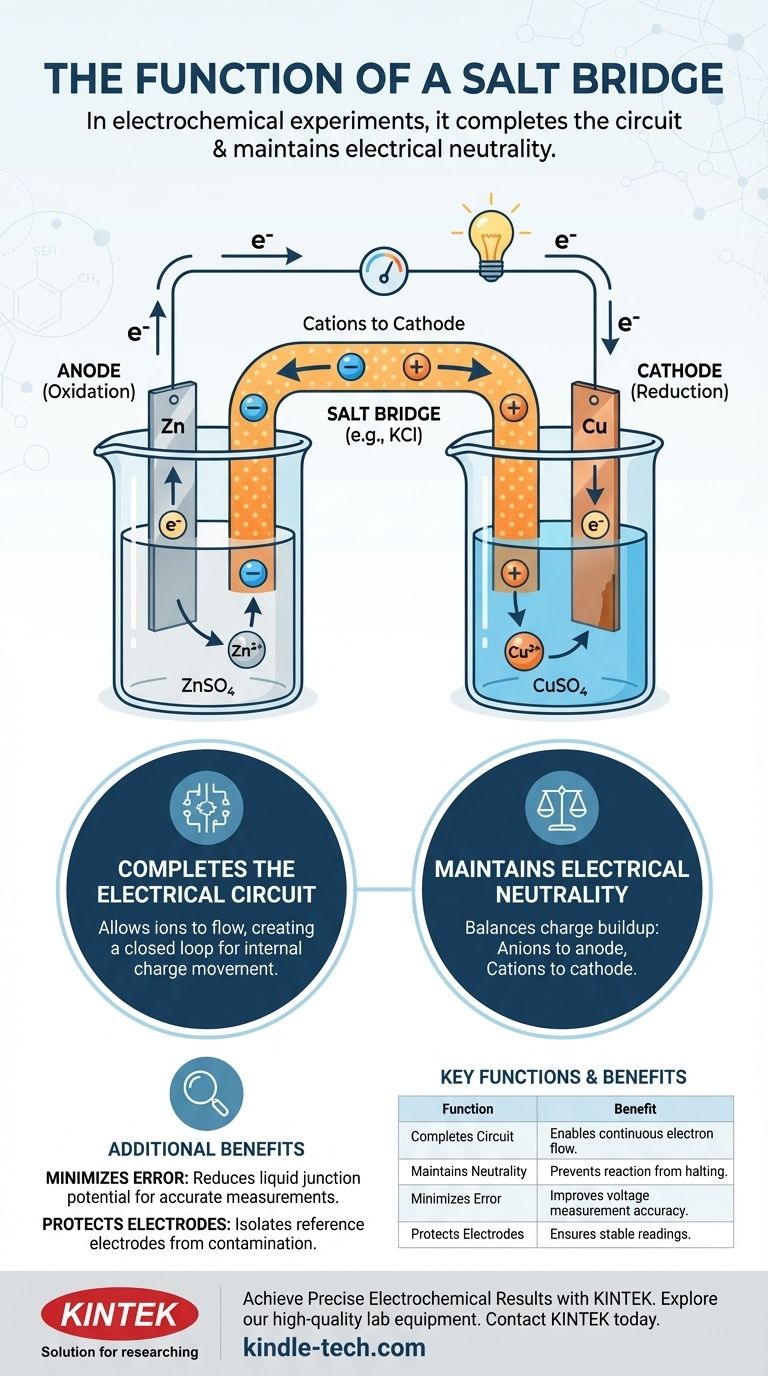
Dans les expériences électrochimiques, un pont salin remplit deux fonctions principales : il complète le circuit électrique en permettant aux ions de circuler entre les deux demi-cellules, et il maintient la neutralité électrique dans chaque demi-cellule. Sans ce composant crucial, la charge s'accumulerait rapidement, arrêtant le flux d'électrons et stoppant la réaction électrochimique presque instantanément.
Un pont salin n'est pas seulement un connecteur ; c'est le mécanisme d'équilibrage des charges qui rend possible une réaction électrochimique soutenue. Il agit en interne, déplaçant les ions pour contrecarrer le déséquilibre de charge créé par le mouvement externe des électrons.

L'anatomie d'une cellule électrochimique
Pour comprendre la fonction d'un pont salin, vous devez d'abord visualiser le système dans lequel il opère. Une cellule électrochimique est fondamentalement un dispositif qui convertit l'énergie chimique en énergie électrique, ou vice versa.
Les deux demi-cellules
Une cellule électrochimique est composée de deux demi-cellules. Chaque demi-cellule contient généralement une électrode (un conducteur solide comme le zinc ou le cuivre) immergée dans une solution électrolytique (une solution contenant des ions, comme le sulfate de zinc ou le sulfate de cuivre).
Dans une demi-cellule, l'oxydation se produit (perte d'électrons), et cette électrode est appelée l'anode. Dans l'autre, la réduction se produit (gain d'électrons), et cette électrode est la cathode.
Le problème : accumulation instantanée de charge
Les électrons générés à l'anode voyagent à travers un fil externe vers la cathode, créant un courant électrique. Cependant, ce flux d'électrons crée un problème immédiat.
Lorsque l'anode perd des électrons, sa solution électrolytique accumule un excès d'ions positifs. Inversement, lorsque la cathode gagne des électrons, sa solution électrolytique développe un excès d'ions négatifs (car les ions positifs de la solution sont consommés). Cette séparation de charge crée une puissante tension opposée qui arrête complètement le flux d'électrons.
Les fonctions principales d'un pont salin
Le pont salin est la solution élégante à ce problème d'accumulation de charge. Il s'agit généralement d'un tube en U rempli d'une solution concentrée d'un électrolyte inerte, tel que le chlorure de potassium (KCl) ou le nitrate de potassium (KNO₃).
Compléter le circuit électrique
Un circuit électrique complet nécessite une boucle fermée. Le fil externe permet aux électrons de circuler, mais ce n'est que la moitié du circuit. Le pont salin complète la boucle en permettant aux ions de circuler entre les demi-cellules, créant un chemin pour que la charge se déplace en interne.
Maintenir la neutralité électrique
C'est la fonction la plus critique du pont salin. Pour neutraliser la charge accumulée :
- Les anions (ions négatifs) du pont salin migrent vers la demi-cellule anodique pour équilibrer l'excès d'ions positifs créés.
- Les cations (ions positifs) du pont salin migrent vers la demi-cellule cathodique pour équilibrer l'excès de charge négative.
En équilibrant constamment la charge dans les deux demi-cellules, le pont salin garantit que la réaction électrochimique peut se poursuivre et qu'un courant stable peut être maintenu.
Minimiser le potentiel de jonction liquide
Dans les mesures plus précises, le pont salin sert également à réduire le potentiel de jonction liquide. Il s'agit d'une petite tension indésirable qui se forme à l'interface de deux solutions électrolytiques différentes. En créant un pont ionique plus graduel, il minimise cette source d'erreur, ce qui conduit à des mesures de potentiel de cellule plus précises.
Comprendre les considérations pratiques
L'efficacité d'un pont salin dépend entièrement de sa composition et de son interaction avec le reste de la cellule.
L'électrolyte doit être inerte
Les ions contenus dans le pont salin ne doivent pas réagir avec les ions des solutions des demi-cellules. Par exemple, l'utilisation d'un pont salin de KCl dans une cellule contenant du nitrate d'argent (AgNO₃) serait une erreur. Les ions chlorure (Cl⁻) réagiraient avec les ions argent (Ag⁺) pour former un précipité solide (AgCl), perturbant le fonctionnement de la cellule.
Protéger l'électrode de référence
Dans une configuration à trois électrodes courante en électrochimie, un pont salin est souvent utilisé pour connecter une électrode de référence (qui a un potentiel constant et connu) à la solution principale. Cela permet d'isoler l'électrode de référence, empêchant les ions de la solution d'essai de la contaminer et d'altérer son potentiel stable. Cela prolonge la durée de vie de l'électrode et assure la précision des mesures.
Faire le bon choix pour votre expérience
Le rôle principal du pont salin est toujours de faciliter le flux d'ions, mais son importance peut être envisagée sous différents angles en fonction de votre objectif.
- Si votre objectif principal est une simple démonstration de pile galvanique : Considérez le pont salin comme le composant qui complète le circuit et permet à la pile de fonctionner en continu.
- Si votre objectif principal est une mesure de tension précise : Le pont salin est essentiel pour minimiser le potentiel de jonction liquide, qui est une source majeure d'erreur expérimentale.
- Si votre objectif principal est l'électrochimie analytique (par exemple, les études de corrosion) : Le pont salin est essentiel pour isoler votre électrode de référence afin de garantir une base stable et fiable pour vos lectures de potentiel.
En fin de compte, le pont salin permet l'étude contrôlée et continue des réactions électrochimiques en résolvant le problème fondamental de la séparation de charge.
Tableau récapitulatif :
| Fonction | Description | Avantage clé |
|---|---|---|
| Complète le circuit | Permet le flux d'ions entre les demi-cellules. | Permet un flux continu d'électrons. |
| Maintient la neutralité | Équilibre l'accumulation de charge due au transfert d'électrons. | Empêche la réaction de s'arrêter. |
| Minimise les erreurs | Réduit le potentiel de jonction liquide. | Améliore la précision de la mesure de tension. |
| Protège les électrodes | Isole les électrodes de référence de la contamination. | Assure des lectures stables et fiables. |
Prêt à obtenir des résultats précis et fiables dans vos expériences électrochimiques ? Le bon équipement est fondamental pour votre succès. KINTEK est spécialisé dans les équipements et consommables de laboratoire de haute qualité, y compris les cellules électrochimiques et les accessoires conçus pour la précision et la durabilité. Laissez nos experts vous aider à choisir la configuration parfaite pour vos besoins de recherche.
Contactez KINTEK dès aujourd'hui pour discuter de la façon dont nous pouvons soutenir les capacités électrochimiques de votre laboratoire !
Guide Visuel
Produits associés
- Cellule électrochimique électrolytique pour l'évaluation des revêtements
- Cellule électrolytique optique à double couche de type H avec bain-marie
- Cellule électrochimique électrolytique à cinq ports
- Bain-marie électrolytique à cinq ports à double couche
- Cellule électrolytique en PTFE Cellule électrochimique scellée et non scellée résistante à la corrosion
Les gens demandent aussi
- Quels sont les avantages d'une cellule électrochimique plate pour la corrosion ? Obtenez une analyse précise des piqûres et des crevasses
- Quelle est la plage de volume de la cellule électrolytique d'évaluation de revêtement ? Un guide pour choisir la bonne taille
- Quelle est la différence entre une cellule de corrosion électrolytique et une cellule de corrosion électrochimique ? Comprendre la force motrice derrière la corrosion
- Quel rôle joue une cellule électrolytique à chemise d'eau dans les mesures de corrosion électrochimique à température variable ?
- Comment le système de cellule électrochimique garantit-il la précision de la mesure lors des tests de réactivation potentiodynamique électrochimique à double boucle (DL-EPR) de l'acier inoxydable super duplex ?


















