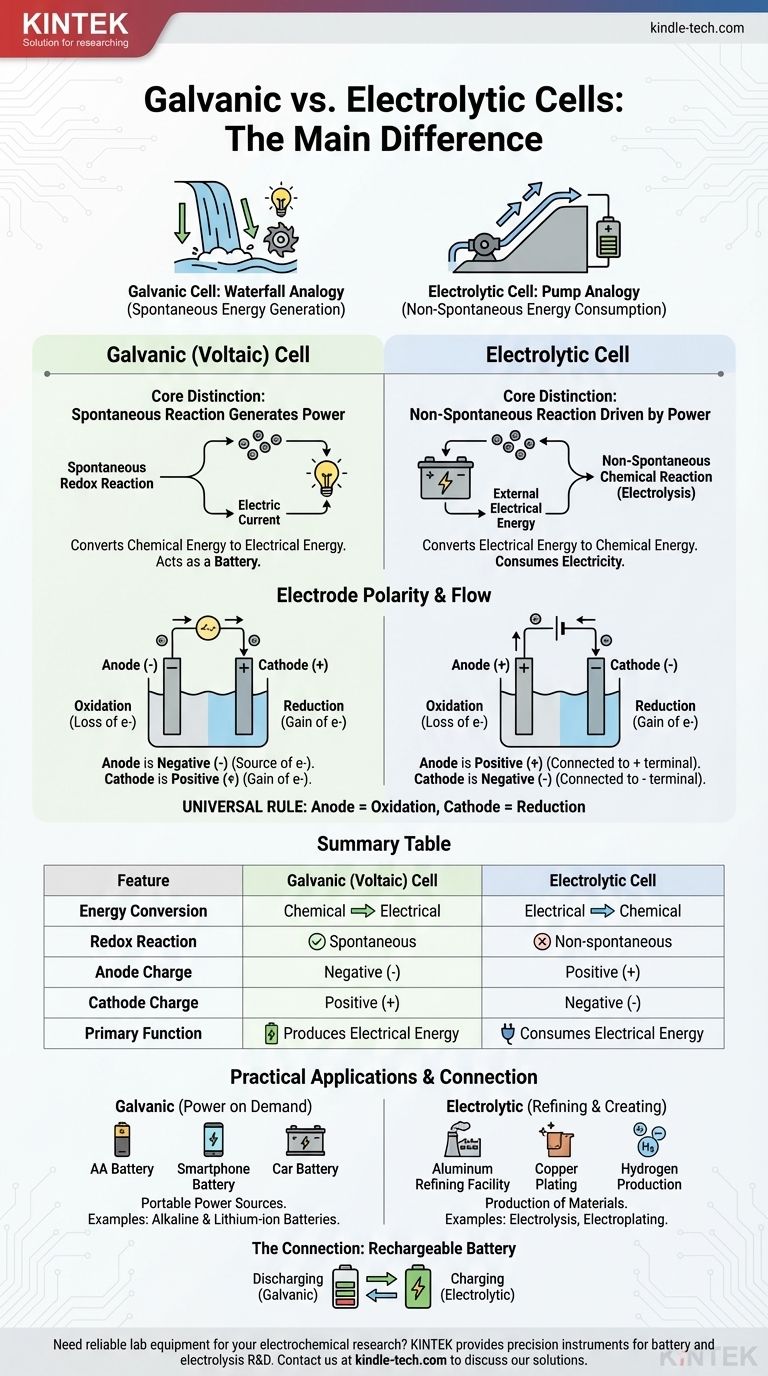
La différence fondamentale réside dans la direction de la conversion d'énergie et la nature de la réaction chimique. Une pile galvanique convertit spontanément l'énergie chimique stockée en énergie électrique, agissant efficacement comme une batterie. En revanche, une cellule électrolytique utilise une source externe d'énergie électrique pour forcer une réaction chimique non spontanée à se produire.
Pensez-y comme la différence entre une cascade générant de l'énergie et une pompe utilisant de l'énergie. Une pile galvanique est comme une cascade, où un processus naturel et spontané (l'eau qui coule en aval) crée de l'énergie. Une cellule électrolytique est comme une pompe, utilisant de l'énergie externe pour forcer un processus qui ne se produirait pas seul (pousser l'eau en amont).

La distinction essentielle : Spontanéité et flux d'énergie
Le comportement de ces deux cellules est régi par un principe : si la réaction redox interne se produit d'elle-même.
Piles galvaniques : Réactions spontanées qui génèrent de l'énergie
Dans une pile galvanique, également connue sous le nom de pile voltaïque, les réactifs chimiques choisis ont une tendance naturelle à réagir les uns avec les autres.
Cette réaction redox spontanée libère de l'énergie. La cellule est construite pour canaliser cette énergie non pas sous forme de chaleur, mais sous forme d'un flux dirigé d'électrons — un courant électrique.
Essentiellement, une pile galvanique exploite un processus chimique naturel pour effectuer un travail électrique. C'est le principe derrière toutes les batteries.
Cellules électrolytiques : Réactions non spontanées entraînées par l'énergie
Dans une cellule électrolytique, la réaction chimique est non spontanée. Les réactifs n'interagiront pas d'eux-mêmes pour produire les produits souhaités.
Pour que la réaction se produise, une source d'alimentation externe (comme une batterie ou une alimentation électrique) est connectée à la cellule. Cette tension externe fournit l'énergie nécessaire pour forcer les électrons à se déplacer et à entraîner le changement chimique.
Les cellules électrolytiques consomment de l'électricité pour créer un produit chimique, un processus connu sous le nom d'électrolyse.
Un regard plus approfondi sur la polarité des électrodes
Bien que les termes "anode" et "cathode" soient constants, leur charge (polarité) est un point de confusion courant car elle est inversée entre les deux types de cellules. La clé est de se souvenir de ce qui entraîne le flux d'électrons.
L'anode : Toujours le site de l'oxydation
Dans les deux types de cellules, l'anode est définie comme l'électrode où se produit l'oxydation (la perte d'électrons). Cette définition est universelle.
La cathode : Toujours le site de la réduction
De même, la cathode est toujours l'électrode où a lieu la réduction (le gain d'électrons). C'est la deuxième règle universelle.
Le changement critique : Pourquoi la polarité change
La différence de polarité provient du fait que la réaction est spontanée ou forcée.
Dans une pile galvanique, l'oxydation spontanée à l'anode libère des électrons, créant une charge négative. L'anode est la borne négative car elle est la source d'électrons qui se déversent dans le circuit.
Dans une cellule électrolytique, une source d'alimentation externe est utilisée. Sa borne positive attire les électrons de l'anode pour forcer l'oxydation. Par conséquent, l'anode est connectée au côté positif et devient la borne positive.
| Caractéristique | Pile galvanique (voltaïque) | Cellule électrolytique |
|---|---|---|
| Conversion d'énergie | Chimique en électrique | Électrique en chimique |
| Réaction redox | Spontanée | Non spontanée |
| Charge de l'anode | Négative (-) | Positive (+) |
| Charge de la cathode | Positive (+) | Négative (-) |
| Fonction principale | Produit de l'énergie électrique | Consomme de l'énergie électrique |
Comprendre les applications pratiques
Cette différence fondamentale conduit à des utilisations distinctes dans la technologie et l'industrie.
Piles galvaniques en action : L'énergie à la demande
Les piles galvaniques sont conçues pour être des sources portables d'énergie électrique. Les exemples courants incluent tous les types de batteries, des piles alcalines AA standard à la batterie lithium-ion de votre téléphone.
Cellules électrolytiques au travail : Raffinage et création
Les cellules électrolytiques utilisent de l'énergie pour produire des matériaux. Des processus industriels clés reposent sur l'électrolyse, tels que la production d'aluminium pur à partir de son minerai, le raffinage du cuivre et la séparation de l'eau pour produire de l'hydrogène et de l'oxygène gazeux. La galvanoplastie, où une fine couche de métal comme l'argent ou le chrome est déposée sur un autre objet, est une autre application courante.
La connexion : Comment fonctionne une batterie rechargeable
Une batterie rechargeable est l'illustration parfaite des deux types de cellules dans un seul appareil.
Lorsqu'elle alimente votre appareil (décharge), elle fonctionne comme une pile galvanique. Une réaction chimique spontanée à l'intérieur de la batterie produit un courant électrique.
Lorsque vous la branchez pour la recharger, le chargeur agit comme une source d'alimentation externe. Il applique une tension qui force la réaction inverse non spontanée à se produire, reconstituant les réactifs. Pendant la charge, la batterie fonctionne comme une cellule électrolytique.
Faire le bon choix pour votre objectif
Votre objectif détermine le cadre électrochimique que vous utilisez.
- Si votre objectif principal est de générer de l'électricité à partir d'un processus chimique : Vous décrivez une pile galvanique (voltaïque).
- Si votre objectif principal est d'utiliser l'électricité pour entraîner un changement chimique spécifique : Vous travaillez avec une cellule électrolytique.
- Si vous analysez une batterie rechargeable : N'oubliez pas qu'elle fonctionne comme une pile galvanique pendant la décharge et comme une cellule électrolytique pendant la recharge.
En fin de compte, la spontanéité de la réaction et la direction résultante du flux d'énergie sont les caractéristiques déterminantes qui séparent ces deux piliers de l'électrochimie.
Tableau récapitulatif :
| Caractéristique | Pile galvanique (voltaïque) | Cellule électrolytique |
|---|---|---|
| Conversion d'énergie | Chimique en électrique | Électrique en chimique |
| Réaction redox | Spontanée | Non spontanée |
| Charge de l'anode | Négative (-) | Positive (+) |
| Charge de la cathode | Positive (+) | Négative (-) |
| Fonction principale | Produit de l'énergie électrique | Consomme de l'énergie électrique |
Besoin d'équipements de laboratoire fiables pour votre recherche électrochimique ? Que vous développiez de nouvelles technologies de batteries ou optimisiez des processus d'électrolyse, KINTEK fournit les instruments de précision et les consommables dont votre laboratoire a besoin. Contactez-nous dès aujourd'hui pour discuter de la manière dont nos solutions peuvent alimenter vos innovations !
Guide Visuel
Produits associés
- Cellule électrochimique électrolytique pour l'évaluation des revêtements
- Cellule électrochimique électrolytique à cinq ports
- Cellule électrolytique optique à double couche de type H avec bain-marie
- Cellule de diffusion de gaz électrolytique électrochimique à flux liquide
- Bain-marie électrochimique multifonctionnel pour cellule électrolytique, simple ou double couche
Les gens demandent aussi
- À quel type de système expérimental la cellule électrolytique tout quartz est-elle destinée ? Électrochimie de précision dans des environnements exigeants
- Qu'est-ce que la corrosion dans une cellule électrochimique ? Comprendre les 4 composants de la dégradation des métaux
- Quels sont les composants et leurs fonctions respectives dans un système de cellule électrolytique de corrosion à plaque plane ? Un guide pour une mesure précise de la corrosion
- Pour quel type de système d'électrodes la cellule électrolytique d'évaluation de revêtement est-elle conçue ? Débloquez une analyse précise des revêtements
- Quelles sont les principales caractéristiques d'une cellule électrolytique de corrosion à plaque plate ? Obtenez des données de corrosion précises et reproductibles















