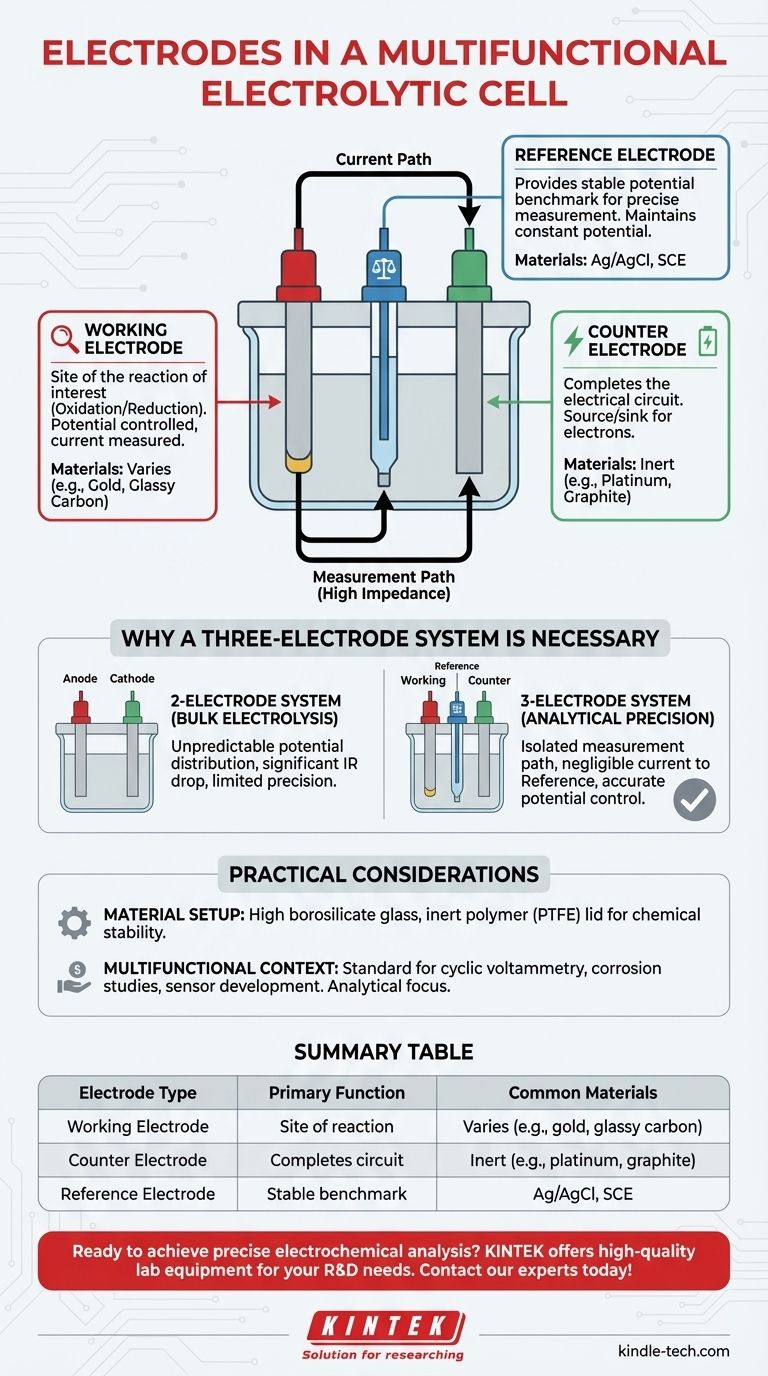
En bref, une cellule électrolytique multifonctionnelle utilise un système à trois électrodes. Ces électrodes sont l'électrode de travail, où se produit la réaction d'intérêt ; l'électrode auxiliaire, qui complète le circuit électrique ; et l'électrode de référence, qui fournit un potentiel stable pour des mesures précises.
L'utilisation d'un système à trois électrodes est la caractéristique clé qui rend la cellule "multifonctionnelle". Contrairement à une simple configuration à deux électrodes pour l'électrolyse en vrac, cette configuration est conçue pour la précision analytique, permettant aux chercheurs de mesurer et de contrôler avec précision le potentiel à l'électrode de travail, indépendamment de la tension globale de la cellule.

Le rôle de chaque électrode dans un système analytique
Une cellule électrolytique standard utilise deux électrodes — une anode et une cathode — pour entraîner une réaction non spontanée. Une cellule multifonctionnelle en ajoute une troisième pour la transformer en un outil de mesure précis. Chacune a un rôle distinct et critique.
L'électrode de travail (le site d'intérêt)
L'électrode de travail est la pièce maîtresse de votre expérience. C'est la surface où se déroule la réaction électrochimique spécifique que vous souhaitez étudier (qu'il s'agisse d'oxydation ou de réduction).
Son potentiel est ce que vous contrôlez, et le courant résultant est ce que vous mesurez. Le matériau de cette électrode est choisi en fonction de la réaction étudiée.
L'électrode auxiliaire (le moteur de courant)
L'électrode auxiliaire (également appelée contre-électrode) agit comme une source ou un puits d'électrons pour équilibrer la réaction à l'électrode de travail. Son seul but est d'assurer la circulation du courant et la fermeture du circuit.
Cette électrode est généralement fabriquée à partir d'un matériau inerte, comme le graphite ou le platine, qui n'interférera pas avec la réaction primaire. C'est l'autre moitié de la paire porteuse de courant, avec l'électrode de travail.
L'électrode de référence (le repère stable)
L'électrode de référence est le composant le plus crucial pour une mesure précise. Elle maintient un potentiel électrochimique constant et connu, agissant comme un repère stable.
Elle est placée près de l'électrode de travail et est connectée à un voltmètre à haute impédance, ce qui signifie qu'il n'y a pratiquement pas de courant qui la traverse. Cela lui permet de mesurer le potentiel exact de l'électrode de travail sans être affectée par les chutes de tension ailleurs dans la cellule.
Pourquoi un système à trois électrodes est nécessaire
Le passage d'une simple cellule à deux électrodes à un système à trois électrodes est motivé par le besoin de précision et de contrôle dans l'analyse électrochimique.
La limitation d'un système à deux électrodes
Dans une cellule de base avec seulement une anode et une cathode, la tension que vous appliquez à partir d'une source d'alimentation est distribuée de manière imprévisible sur plusieurs composants : l'anode, la cathode et la solution électrolytique elle-même (appelée chute IR).
Vous ne pouvez pas connaître le potentiel précis à la surface de l'électrode où se déroule votre réaction d'intérêt. Cela rend impossible d'effectuer une analyse quantitative ou d'étudier la cinétique des réactions de manière fiable.
La précision d'un système à trois électrodes
La configuration à trois électrodes isole la fonction de mesure de la fonction de pilotage du courant.
Le chemin du courant se situe entre les électrodes de travail et auxiliaire. Le chemin de mesure séparé se situe entre les électrodes de travail et de référence. Étant donné que l'électrode de référence ne tire qu'un courant négligeable, son potentiel reste stable, vous donnant une lecture fidèle du potentiel de l'électrode de travail.
Comprendre les considérations pratiques
Bien que puissant, l'efficacité de ce système dépend de sa bonne mise en œuvre et de la compréhension de son contexte.
Matériel et configuration physique
Les composants de la cellule sont choisis pour leur inertie chimique et leur stabilité. Le corps est souvent en verre borosilicaté de haute qualité, avec un couvercle en polymère non réactif comme le PTFE (Téflon).
Cette construction robuste garantit que la cellule elle-même ne contamine pas ou ne réagit pas avec l'électrolyte ou les produits de la réaction électrochimique, préservant ainsi l'intégrité de l'expérience.
Le contexte "multifonctionnel"
Une cellule à trois électrodes n'est pas conçue pour la production à l'échelle industrielle. Son but est analytique.
Cette configuration est la norme pour des techniques comme la voltamétrie cyclique, les études de corrosion et le développement de capteurs, où un contrôle et une mesure précis du potentiel de l'électrode sont primordiaux pour comprendre les processus électrochimiques sous-jacents.
Faire le bon choix pour votre objectif
La configuration d'électrodes appropriée dépend entièrement de votre objectif.
- Si votre objectif principal est l'électrolyse en vrac (par exemple, la production de chlore gazeux) : Un système à deux électrodes plus simple (anode et cathode) est généralement suffisant et plus rentable.
- Si votre objectif principal est l'analyse électrochimique (par exemple, la mesure des vitesses de réaction ou des concentrations) : Le système à trois électrodes (de travail, auxiliaire, de référence) est essentiel pour des données précises et reproductibles.
- Si votre objectif principal est la caractérisation des matériaux (par exemple, le test d'un nouveau catalyseur) : La configuration à trois électrodes est la norme pour quantifier les propriétés électrochimiques de votre matériau, qui sert d'électrode de travail.
En fin de compte, le système à trois électrodes vous permet d'aller au-delà de la simple conduite d'une réaction pour l'étudier et la comprendre avec précision.
Tableau récapitulatif :
| Type d'électrode | Fonction principale | Matériaux courants |
|---|---|---|
| Électrode de travail | Site de la réaction étudiée | Varie selon la réaction (par exemple, or, carbone vitreux) |
| Électrode auxiliaire | Complète le circuit électrique | Matériaux inertes (par exemple, platine, graphite) |
| Électrode de référence | Fournit un repère de potentiel stable | Argent/Chlorure d'argent (Ag/AgCl), Calomel saturé (SCE) |
Prêt à réaliser une analyse électrochimique précise dans votre laboratoire ? La bonne cellule électrolytique multifonctionnelle est essentielle pour des résultats précis. KINTEK est spécialisé dans les équipements de laboratoire de haute qualité, y compris les cellules électrochimiques et les consommables, pour soutenir votre recherche et développement. Contactez nos experts dès aujourd'hui pour trouver la solution parfaite pour les besoins de votre laboratoire et améliorer vos expériences électrochimiques !
Guide Visuel
Produits associés
- Cellule électrolytique optique à double couche de type H avec bain-marie
- Cellule électrochimique électrolytique pour l'évaluation des revêtements
- Cellule électrochimique électrolytique en quartz pour expériences électrochimiques
- Électrode de référence au sulfate de cuivre pour usage en laboratoire
- Électrode à disque d'or
Les gens demandent aussi
- Quels sont les volumes typiques et les configurations d'ouverture pour une cellule électrolytique à double couche à bain-marie ? Optimisez votre configuration électrochimique
- Qu'est-ce qu'une cellule de type H ? Un guide des cellules électrochimiques divisées pour des expériences précises
- Comment doit-on stocker la cellule électrolytique de type H lorsqu'elle n'est pas utilisée ? Guide expert de stockage et de maintenance
- Quelles sont les caractéristiques clés d'une cellule électrolytique à double enveloppe à bain-marie ? Obtenez un contrôle précis de la température pour vos expériences
- Quel est le but de la structure à double paroi dans la cellule électrolytique de type H ? Atteindre un contrôle thermique précis


















