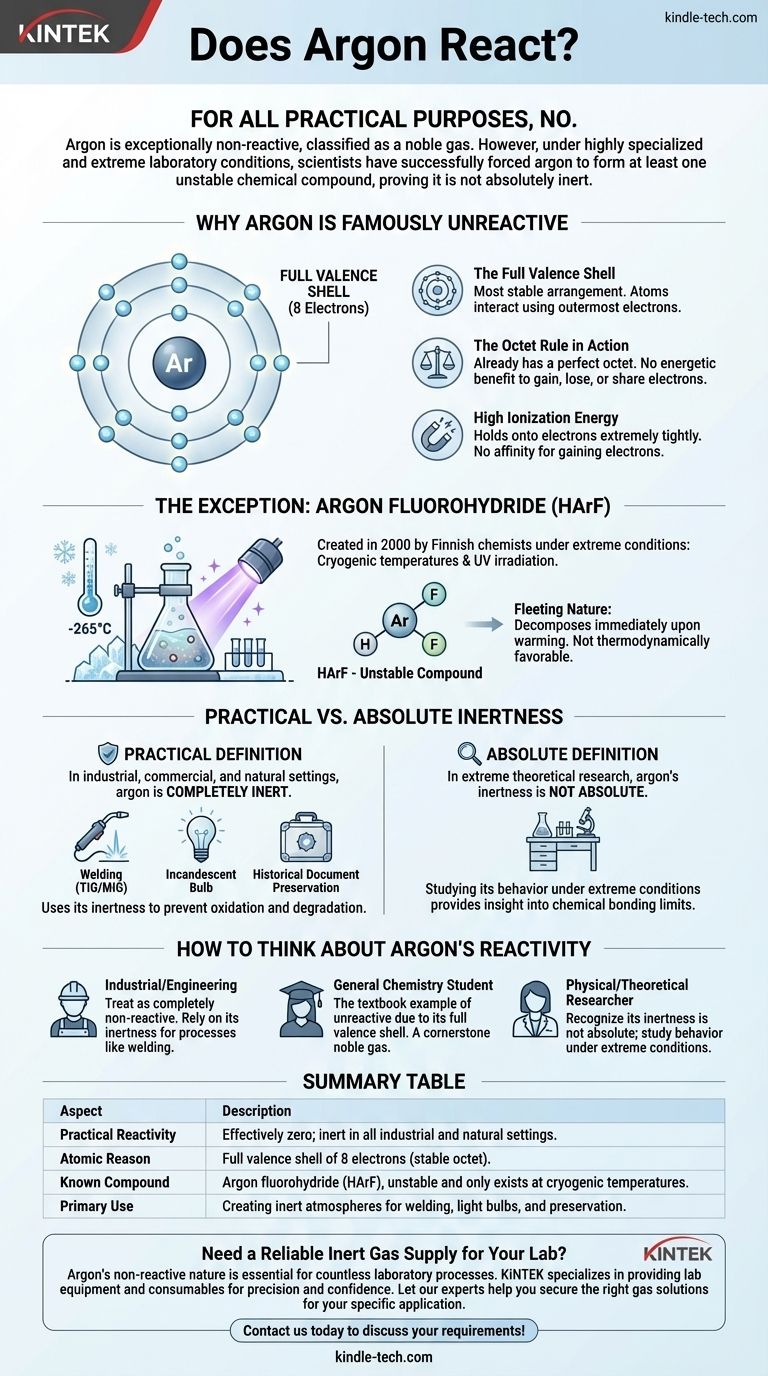
À toutes fins utiles, non. L'argon est exceptionnellement non réactif, c'est pourquoi il est classé comme un gaz noble. Cependant, dans des conditions de laboratoire très spécialisées et extrêmes, les scientifiques ont réussi à forcer l'argon à former au moins un composé chimique instable, prouvant qu'il n'est pas absolument inerte.
Le point essentiel à retenir est que la "réactivité" d'un élément n'est pas une simple question de oui ou de non. Bien que la configuration parfaite de la couche électronique de l'argon le rende inerte dans tout contexte naturel ou industriel, sa non-réactivité peut être surmontée avec suffisamment d'énergie dans des conditions cryogéniques, révélant les subtiles complexités de la liaison chimique.

Pourquoi l'argon est-il réputé "non réactif" ?
Pour comprendre pourquoi l'argon résiste si fortement à la formation de liaisons chimiques, nous devons examiner sa structure atomique. Sa réputation d'être inerte n'est pas arbitraire ; elle est le résultat direct de sa configuration électronique.
La couche de valence complète
Les atomes interagissent et forment des liaisons en utilisant leurs électrons les plus externes, appelés électrons de valence.
L'argon possède huit électrons de valence, ce qui remplit complètement sa couche électronique externe. C'est l'arrangement le plus stable qu'un atome puisse avoir.
La "règle de l'octet" en action
La "règle de l'octet" est un principe fondamental en chimie stipulant que les atomes ont tendance à gagner, perdre ou partager des électrons pour atteindre une couche externe complète de huit électrons.
Parce que l'argon possède déjà cet octet parfait, il n'y a aucun avantage énergétique pour lui à gagner, perdre ou partager des électrons avec d'autres atomes. Il est déjà dans son état idéal de basse énergie.
Énergie d'ionisation élevée
L'énergie d'ionisation est l'énergie nécessaire pour retirer un électron d'un atome. L'argon a une énergie d'ionisation très élevée, ce qui signifie qu'il retient ses électrons extrêmement fermement.
De même, il n'a aucune affinité pour gagner des électrons. Il n'y a tout simplement aucun "motif" chimique pour que l'argon s'engage dans une réaction dans des circonstances normales.
L'exception qui confirme la règle
Pendant des décennies, l'argon a été considéré comme complètement inerte. Cela a changé en l'an 2000 lorsqu'une équipe de chimistes finlandais a créé le premier véritable composé d'argon connu.
Forcer une réaction dans des conditions extrêmes
Le composé, l'argon fluorohydrure (HArF), n'a pas été créé dans un bécher de laboratoire typique.
Les scientifiques ont dû congeler un mélange d'argon et de fluorure d'hydrogène sur une surface à des températures proches du zéro absolu (environ -265°C ou -445°F), puis l'irradier avec une puissante lumière ultraviolette. Cet apport d'énergie extrême a été suffisant pour forcer temporairement l'atome d'argon réticent à former une liaison.
La nature éphémère des composés d'argon
Le composé HArF résultant est incroyablement instable. Il n'existe qu'à ces températures cryogéniques.
S'il est réchauffé, même légèrement, les liaisons faibles se rompent, et il se décompose immédiatement en argon et fluorure d'hydrogène séparés. Cela souligne que le composé n'est pas thermodynamiquement favorable et n'existe que parce qu'il est "piégé" par le froid extrême.
Inertie pratique vs. inertie absolue
Cette découverte nous oblige à distinguer deux concepts : ce qui est vrai dans un sens pratique et ce qui est vrai dans un sens absolu, théorique.
La définition pratique de l'inerte
Dans tout environnement industriel, commercial ou naturel, l'argon est complètement inerte. Il ne réagit pas avec l'air, l'eau, les métaux ou toute autre substance avec laquelle il entre en contact.
C'est cette inertie pratique qui le rend si précieux.
Pourquoi cela est important pour les applications
La non-réactivité de l'argon est une caractéristique, pas une limitation. Dans le soudage (TIG/MIG), il crée un "bouclier" inerte autour du métal en fusion, l'empêchant de s'oxyder ou de réagir avec les gaz de l'air, ce qui garantit une soudure propre et solide.
Dans les ampoules à incandescence, une atmosphère d'argon empêche le filament de tungstène chaud de brûler. Dans la conservation des documents historiques, il fournit un environnement sans oxygène pour arrêter la dégradation.
Comment considérer la réactivité de l'argon
Votre contexte détermine la façon dont vous devez considérer le comportement chimique de l'argon. Comprendre cette distinction est essentiel pour appliquer correctement les principes chimiques.
- Si vous travaillez dans un environnement industriel ou d'ingénierie : Traitez l'argon comme un gaz complètement non réactif. Son inertie est sa propriété la plus précieuse et peut être utilisée en toute confiance pour des processus comme le soudage et la fabrication.
- Si vous êtes un étudiant en chimie générale : Comprenez que l'argon est l'exemple typique d'un élément non réactif en raison de sa couche de valence complète, ce qui en fait une pierre angulaire du groupe des gaz nobles.
- Si vous êtes un chercheur en chimie physique ou théorique : Reconnaissez que l'inertie de l'argon n'est pas absolue, et l'étude de son comportement dans des conditions extrêmes fournit un aperçu précieux des limites de la liaison chimique.
En fin de compte, l'extrême réticence de l'argon à réagir est une propriété fondamentale qui le rend à la fois scientifiquement intéressant et immensément utile dans le monde réel.
Tableau récapitulatif :
| Aspect | Description |
|---|---|
| Réactivité pratique | Effectivement nulle ; inerte dans tous les environnements industriels et naturels. |
| Raison atomique | Couche de valence complète de 8 électrons (octet stable). |
| Composé connu | Fluorohydrure d'argon (HArF), instable et n'existe qu'à des températures cryogéniques. |
| Utilisation principale | Création d'atmosphères inertes pour le soudage, les ampoules et la conservation. |
Besoin d'un approvisionnement fiable en gaz inerte pour votre laboratoire ?
La nature non réactive de l'argon est essentielle pour d'innombrables processus de laboratoire, de la création d'atmosphères contrôlées à la manipulation de matériaux sensibles. Assurer un approvisionnement constant et de haute pureté est essentiel pour vos résultats.
KINTEK est spécialisé dans la fourniture de l'équipement de laboratoire et des consommables dont vous avez besoin pour opérer avec précision et confiance. Laissez nos experts vous aider à obtenir les bonnes solutions de gaz pour votre application spécifique.
Contactez-nous dès aujourd'hui via notre formulaire pour discuter de vos besoins !
Guide Visuel
Produits associés
- Circulateur réfrigérant 10L Bain d'eau de refroidissement Bain de réaction à température constante basse température
- Collecteur de courant en feuille d'aluminium pour batterie au lithium
- Four de Fusion par Induction sous Vide à l'Échelle du Laboratoire
- Pulvérisateur ultrafin vibrant refroidi par eau à basse température avec écran tactile
- Fabricant de pièces personnalisées en PTFE Téflon Bol de broyage
Les gens demandent aussi
- Quelle est l'importance de l'utilisation d'argon de haute pureté dans les fours à haute température ? Assurer la précision des tests de stabilité des revêtements
- Quels sont les avantages de l'utilisation d'un four à atmosphère contrôlée pour le recuit de l'acier 316LN ? Préserver la résistance et la surface.
- Quel rôle joue un four de recuit à haute température dans la régulation des propriétés des nanoparticules d'oxyde de cérium ?
- Pourquoi l'azote est-il utilisé dans les fours ? Avantages clés pour les processus à haute température
- Qu'est-ce qu'une atmosphère de gaz inerte et à quelles applications est-elle utilisée ? Guide essentiel pour le traitement thermique et la sécurité en laboratoire
- Qu'est-ce que l'atmosphère d'un four ? Un guide pour contrôler votre processus thermique
- Pourquoi un processus de recuit sous atmosphère contrôlée est-il nécessaire pour l'activation des catalyseurs TaNOC ? Étapes clés pour réussir
- Comment un four à atmosphère à haute température facilite-t-il le RAB ? Optimiser le joint céramique-métal à l'air














