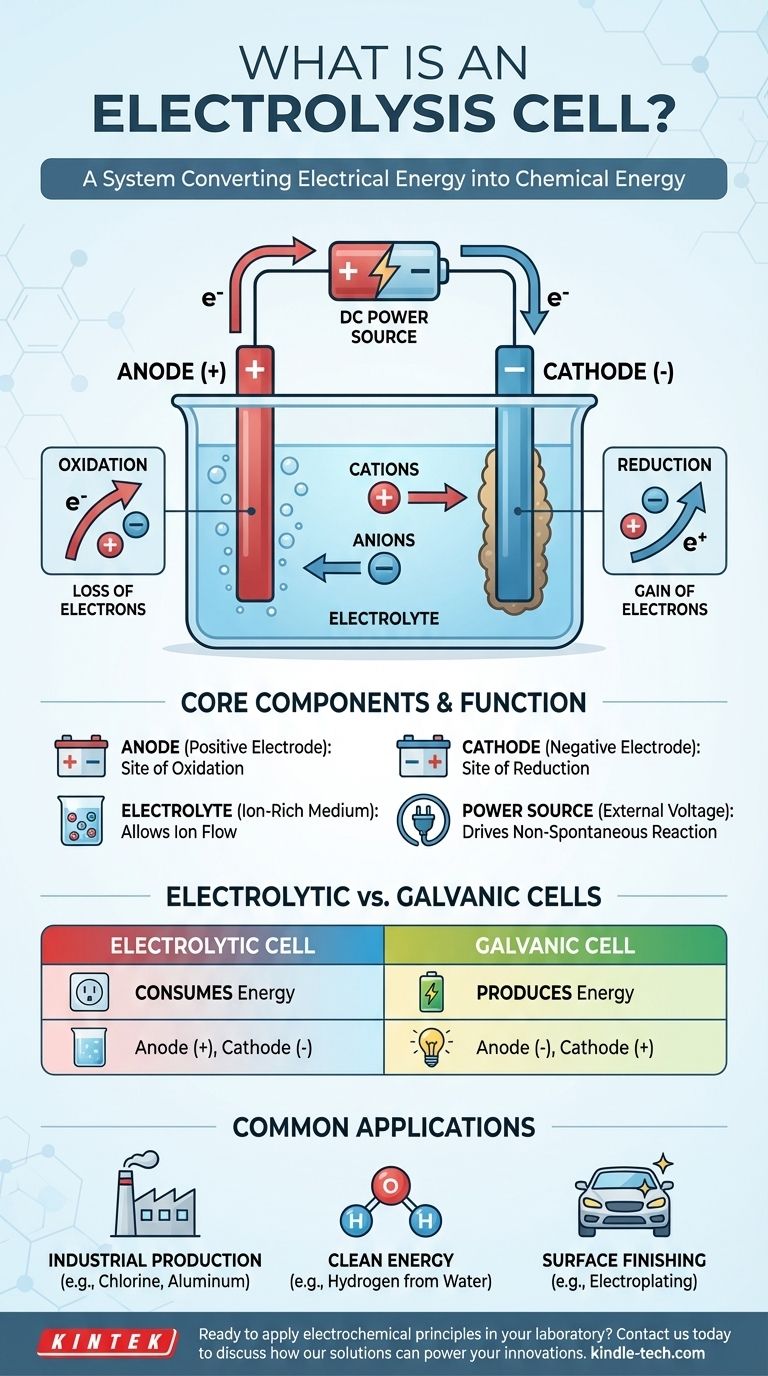
Fondamentalement, une cellule électrolytique est un dispositif qui utilise l'énergie électrique pour provoquer une réaction chimique qui ne se produirait pas d'elle-même. Elle inverse efficacement le processus d'une batterie, consommant de l'énergie pour décomposer des composés ou en synthétiser de nouveaux. Ceci est réalisé en faisant passer un courant électrique continu à travers une substance appelée électrolyte, forçant des changements chimiques au niveau de deux électrodes.
Une cellule électrolytique est mieux comprise comme un système de conversion de l'énergie électrique en énergie chimique. Elle fonctionne en appliquant une tension externe pour surmonter l'état naturel d'un système chimique, forçant les ions à réagir et à créer de nouvelles substances.

Comment fonctionne une cellule électrolytique
Pour saisir le concept, il est essentiel de comprendre les trois composants principaux et la façon dont ils interagissent lorsque l'électricité est introduite. Le processus est un flux de charge contrôlé et dirigé qui entraîne une transformation chimique.
Les trois composants essentiels
Une cellule électrolytique est composée de trois parties principales :
- Une Anode : L'électrode connectée à la borne positive de la source d'alimentation.
- Une Cathode : L'électrode connectée à la borne négative de la source d'alimentation.
- Un Électrolyte : Une substance contenant des ions libres, comme un sel fondu ou un composé ionique dissous dans un solvant comme l'eau.
Le rôle de la tension externe
Contrairement à une batterie (une pile galvanique) qui produit spontanément de la tension, une cellule électrolytique nécessite une source d'alimentation externe. Cette tension appliquée établit un champ électrique puissant et dicte la polarité des électrodes, rendant l'anode positive et la cathode négative.
Le flux d'ions et d'électrons
La tension appliquée force les ions au sein de l'électrolyte à migrer. Les ions chargés positivement (cations) sont attirés vers la cathode négative, tandis que les ions chargés négativement (anions) sont attirés vers l'anode positive. Cette migration prépare le terrain pour les réactions chimiques.
Oxydation et réduction : la chimie fondamentale
Le changement chimique réel se produit à la surface des électrodes. Ces réactions sont appelées réactions "redox", abréviation de réduction et oxydation.
L'anode : site d'oxydation
L'anode est définie comme le site d'oxydation. Ici, les anions qui ont migré vers l'électrode positive cèdent leurs électrons en excès. Cette perte d'électrons est la définition de l'oxydation.
La cathode : site de réduction
La cathode est définie comme le site de réduction. Les cations attirés par cette électrode négative acceptent les électrons du circuit. Ce gain d'électrons est la définition de la réduction, entraînant souvent le dépôt d'un élément neutre (comme un métal) sur la cathode.
Comprendre la distinction clé : cellules électrolytiques vs. galvaniques
Un point de confusion courant est la différence entre une cellule électrolytique et une cellule galvanique (comme une batterie courante). Comprendre leurs fonctions opposées est essentiel.
Consommation d'énergie vs. production d'énergie
La différence la plus importante est le flux d'énergie. Une cellule électrolytique consomme de l'énergie pour provoquer une réaction non spontanée. Une cellule galvanique libère de l'énergie d'une réaction spontanée.
Polarité des électrodes
Cette différence de fonction entraîne une convention de signe opposée pour les électrodes.
- Dans une cellule électrolytique, l'anode est positive et la cathode est négative.
- Dans une cellule galvanique, l'anode est négative et la cathode est positive.
Rappelez-vous que dans les deux types de cellules, l'oxydation se produit toujours à l'anode et la réduction se produit toujours à la cathode. La polarité est ce qui change.
Applications courantes de l'électrolyse
La capacité de forcer un changement chimique avec l'électricité rend les cellules électrolytiques incroyablement utiles dans de nombreuses industries.
Production industrielle
L'électrolyse est la pierre angulaire de l'industrie du chlore-alcali, qui produit du chlore gazeux et de l'hydroxyde de sodium. Elle est également essentielle pour produire des métaux purs comme l'aluminium et le cuivre à partir de leurs minerais.
Énergie propre
L'une des applications les plus prometteuses est l'électrolyse de l'eau. En faisant passer un courant à travers l'eau, celle-ci peut être séparée en ses éléments constitutifs : l'hydrogène et l'oxygène. L'hydrogène résultant peut être utilisé comme carburant propre.
Finition de surface
L'électrodéposition est un processus courant où une cellule électrolytique est utilisée pour déposer une fine couche d'un métal (comme l'or ou le chrome) sur la surface d'un autre objet, qui agit comme cathode.
Faire le bon choix pour votre objectif
Comprendre le principe de l'électrolyse vous permet de l'appliquer à des objectifs spécifiques.
- Si votre objectif principal est la production de matériaux (par exemple, l'hydrogène) : Reconnaissez que la cellule est un outil pour décomposer des composés stables et de faible énergie (comme l'eau) en produits de grande énergie et de grande valeur (comme le gaz H₂).
- Si votre objectif principal est le revêtement de surface (électrodéposition) : Comprenez que votre objet cible doit être la cathode, car c'est là que les ions métalliques positifs seront réduits et déposés sous forme de couche solide.
- Si votre objectif principal est l'électrochimie fondamentale : Le point le plus crucial est qu'une cellule électrolytique utilise de l'énergie externe pour inverser un processus chimique naturel, ce qui en fait un moteur puissant pour la synthèse.
En maîtrisant ces principes, vous pouvez exploiter l'électrolyse comme un outil puissant et précis pour la transformation chimique.
Tableau récapitulatif :
| Composant | Fonction | Caractéristique clé |
|---|---|---|
| Anode | Site d'oxydation (perte d'électrons) | Connectée à la borne positive de la source d'alimentation |
| Cathode | Site de réduction (gain d'électrons) | Connectée à la borne négative de la source d'alimentation |
| Électrolyte | Fournit un milieu pour le flux d'ions | Un sel fondu ou une solution ionique contenant des ions libres |
| Source d'alimentation | Provoque la réaction non spontanée | Fournit la tension externe requise pour l'électrolyse |
Prêt à appliquer les principes électrochimiques dans votre laboratoire ?
Que votre projet implique la synthèse de matériaux, l'électrodéposition ou le développement de solutions d'énergie propre, disposer du bon équipement est fondamental. KINTEK est spécialisé dans la fourniture d'équipements de laboratoire et de consommables de haute qualité pour soutenir votre recherche et développement électrochimique.
Contactez-nous dès aujourd'hui pour discuter de la façon dont nos solutions peuvent alimenter vos innovations et fournir la précision et la fiabilité dont votre laboratoire a besoin.
Guide Visuel
Produits associés
- Cellule électrochimique électrolytique à cinq ports
- Cellule électrolytique de type H Triple Cellule électrochimique
- Cellule électrolytique optique à double couche de type H avec bain-marie
- Cellule électrochimique électrolytique en quartz pour expériences électrochimiques
- Cellule électrochimique électrolytique pour l'évaluation des revêtements
Les gens demandent aussi
- Comment la cellule électrolytique à bain-marie à cinq ports doit-elle être utilisée pendant une expérience ? Maîtrisez un contrôle précis pour des résultats fiables
- Comment prévenir les fuites lors de l'utilisation d'une cellule électrolytique à cinq ports avec bain-marie ? Assurez une configuration électrochimique fiable et sûre
- Comment éviter la contamination lors des expériences avec la cellule électrolytique à bain-marie à cinq orifices ? Maîtrisez le Protocole des 3 Piliers
- Quelle précaution générale doit être prise lors de la manipulation de la cellule électrolytique ? Assurer des résultats de laboratoire sûrs et précis
- Comment nettoyer une cellule électrolytique à bain-marie à cinq orifices pour l'entretien ? Un guide étape par étape pour des résultats fiables



















