Le gaz inerte le plus courant dans l'atmosphère terrestre est l'argon (Ar). Il représente environ 0,93 % de l'air que nous respirons, ce qui en fait le troisième gaz le plus abondant au total, après l'azote et l'oxygène.
Bien que l'argon soit la réponse définitive, la compréhension plus profonde réside dans la distinction entre la définition chimique d'un « gaz noble » et l'application pratique d'un « gaz inerte » en science et dans l'industrie.
Qu'est-ce qui rend un gaz « inerte » ?
Le terme « inerte » fait référence à une substance chimiquement inactive. Dans le contexte des gaz, cette propriété est le plus souvent associée à un groupe spécifique d'éléments du tableau périodique.
La famille des gaz nobles
Les gaz inertes sont également connus sous le nom de gaz nobles. Ce groupe comprend l'hélium, le néon, l'argon, le krypton, le xénon et le radon.
Leur caractéristique distinctive est une couche externe d'électrons complète. Cette configuration stable les rend extrêmement réticents à partager, gagner ou perdre des électrons.
Stabilité chimique extrême
Parce qu'ils ne forment pas facilement de liaisons chimiques avec d'autres éléments, les gaz nobles sont très peu réactifs. Ils existent sous forme d'atomes individuels, et non sous forme de molécules comme l'oxygène (O₂) ou l'azote (N₂).
Pourquoi cette propriété est importante
Cette non-réactivité est incroyablement utile. Les gaz inertes sont utilisés pour créer un environnement stable pour des processus comme le soudage, pour empêcher les filaments de griller dans les ampoules à incandescence et pour préserver les matériaux sensibles.
Un regard plus attentif sur l'atmosphère terrestre
Pour comprendre la place de l'argon, il est crucial de voir l'image complète de la composition de notre atmosphère.
Les deux gaz dominants
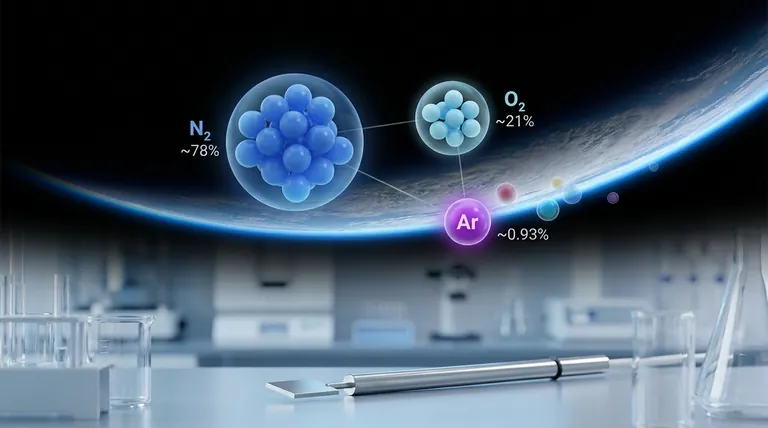
L'air est majoritairement composé de deux gaz : l'azote (N₂) à environ 78 % et l'oxygène (O₂) à environ 21 %. Ces deux éléments constituent 99 % de l'air.
Position de l'argon
Le 1 % restant est l'endroit où nous trouvons l'argon. À environ 0,93 %, c'est de loin le gaz noble le plus significatif présent.
Traces d'autres gaz nobles
Les autres gaz nobles existent en quantités beaucoup plus faibles. À titre de comparaison, le néon est présent à environ 0,0018 %, tandis que l'hélium, le krypton et le xénon se trouvent en quantités encore plus faibles.
Comprendre les nuances
Les termes « inerte » et « gaz noble » sont souvent utilisés de manière interchangeable, mais il existe des distinctions importantes à comprendre.
« Inerte » est-il vraiment inerte ?
Bien que les gaz nobles soient très stables, ils ne sont pas complètement inertes dans toutes les conditions. Les scientifiques ont forcé des gaz nobles comme le xénon et le krypton à former des composés chimiques en laboratoire sous pression et température extrêmes.
Azote : le gaz « presque » inerte
L'azote gazeux (N₂) n'est pas un gaz noble. Cependant, la forte triple liaison qui maintient ses deux atomes ensemble le rend très stable et non réactif dans de nombreuses conditions.
Parce qu'il est beaucoup plus abondant et moins cher que l'argon, l'azote est fréquemment utilisé comme gaz « inerte » pour des applications industrielles comme l'emballage alimentaire et la fabrication d'électronique, où une non-réactivité extrême n'est pas requise.
Mettre tout en perspective
Le choix ou l'identification d'un gaz inerte dépend entièrement du contexte de votre question — vous concentrez-vous sur la pureté chimique ou l'application pratique ?
- Si votre objectif principal est la chimie : l'argon est le gaz noble le plus abondant, défini par sa structure atomique et sa couche électronique complète.
- Si votre objectif principal est la composition atmosphérique : l'argon est le troisième gaz le plus courant dans l'air, mais il est loin derrière l'azote et l'oxygène.
- Si votre objectif principal est l'utilisation industrielle : le choix entre l'argon et l'azote dépend souvent du niveau de non-réactivité requis par rapport au coût, l'azote étant un substitut courant.
Comprendre la distinction entre la nature élémentaire d'un gaz et son comportement pratique est essentiel pour maîtriser le sujet.
Tableau récapitulatif :
| Gaz | Type | Abondance dans l'atmosphère | Caractéristique clé |
|---|---|---|---|
| Argon (Ar) | Gaz noble (inerte) | ~0,93 % | Gaz inerte le plus courant ; couche électronique complète |
| Azote (N₂) | Gaz diatomique | ~78 % | Souvent utilisé comme gaz inerte pratique et rentable |
| Hélium (He) | Gaz noble (inerte) | Traces | Très faible abondance mais très inerte |
| Néon (Ne) | Gaz noble (inerte) | ~0,0018 % | Faible abondance ; utilisé dans l'éclairage |
Besoin d'un approvisionnement fiable en gaz inerte pour votre laboratoire ?
Comprendre les propriétés des gaz comme l'argon est crucial pour un travail de laboratoire précis. Que vous ayez besoin de gaz inertes ultra-purs pour des expériences sensibles ou de systèmes de livraison de gaz fiables, KINTEK possède l'expertise et l'équipement pour soutenir votre recherche. Nous sommes spécialisés dans la fourniture d'équipements et de consommables de laboratoire de haute qualité pour garantir que vos processus sont efficaces et sans contamination.
Contactez nos experts dès aujourd'hui pour discuter de la manière dont nous pouvons répondre à vos besoins spécifiques en gaz de laboratoire !
Guide Visuel

Produits associés
- Électrode en feuille de platine pour applications de laboratoire et industrielles
- Feuille et plaque de titane de haute pureté pour applications industrielles
- Bille en céramique de zircone usinée avec précision pour la céramique fine avancée d'ingénierie
- Fabricant de pièces personnalisées en PTFE Téflon pour boîtes de culture et boîtes d'évaporation
- Four tubulaire à fente de 1200℃ avec tube en quartz pour four tubulaire de laboratoire
Les gens demandent aussi
- Comment un électrode à feuille de platine doit-elle être utilisée pendant une expérience ? Assurez des résultats précis et reproductibles
- Comment prétraiter une électrode en feuille de platine avant utilisation ? Assurer des mesures électrochimiques précises
- Quelle est la directive la plus critique pour immerger une électrode en feuille de platine dans un électrolyte ? Assurer des mesures électrochimiques précises
- Quelles précautions doivent être prises lors de l'utilisation d'une électrode en feuille de platine ? Assurez des données électrochimiques précises et reproductibles
- Quelles sont les spécifications disponibles pour les électrodes en feuille de platine ? Trouvez l'ajustement parfait pour vos besoins électrochimiques







