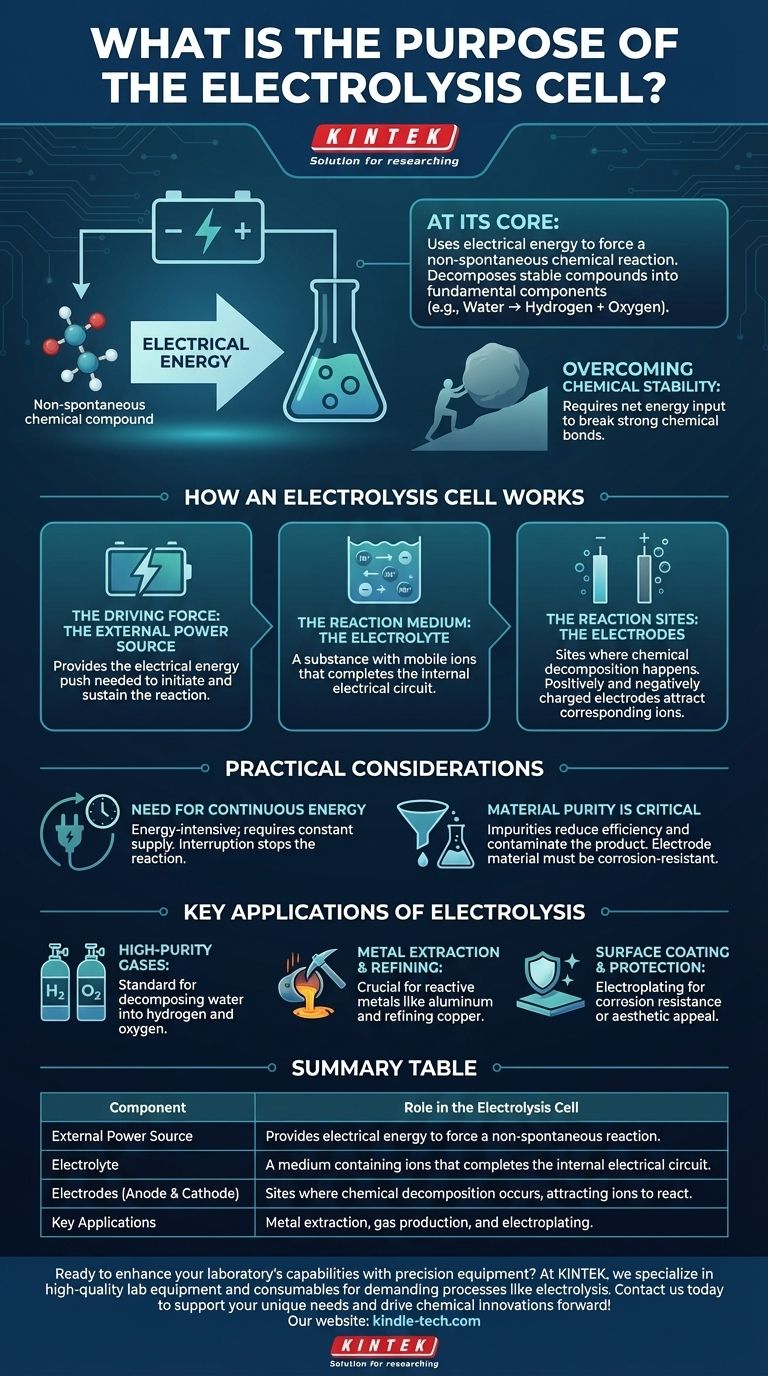
Fondamentalement, le but d'une cellule d'électrolyse est d'utiliser l'énergie électrique pour forcer une réaction chimique qui ne se produirait pas spontanément. Ce processus, connu sous le nom d'électrolyse, nous permet de décomposer des composés chimiques stables en leurs composants les plus fondamentaux, comme la décomposition de l'eau en hydrogène et en oxygène.
Bien que de nombreuses réactions chimiques libèrent de l'énergie, certains des processus industriels les plus importants nécessitent un apport énergétique pour se produire. La cellule d'électrolyse est l'outil fondamental conçu pour fournir cette énergie, en utilisant l'électricité pour piloter des réactions non spontanées et créer des produits chimiques de valeur.

Comment fonctionne une cellule d'électrolyse
Une cellule d'électrolyse est un système comportant trois composants critiques qui fonctionnent ensemble pour réaliser un changement chimique spécifique. Comprendre chaque partie clarifie l'ensemble du processus.
La force motrice : la source d'alimentation externe
Une source d'alimentation externe, telle qu'une batterie, fournit l'énergie électrique requise. Cette énergie agit comme la « poussée » nécessaire pour initier et soutenir une réaction chimique qui n'est pas énergétiquement favorable. Sans cette tension externe, la décomposition ne se produirait pas.
Le milieu réactionnel : l'électrolyte
L'électrolyte est le milieu qui permet la circulation des particules chargées (ions). Ce n'est pas simplement un liquide ; c'est une substance, généralement une solution de sels dissous dans l'eau ou un sel en fusion, qui contient des ions mobiles. Ce mouvement des ions entre les électrodes est ce qui complète le circuit électrique à l'intérieur de la cellule.
Les sites de réaction : les électrodes
Deux électrodes (une anode et une cathode) sont immergées dans l'électrolyte. Ce sont les sites physiques où la décomposition chimique se produit réellement. Lorsque la source d'alimentation externe est appliquée, une électrode devient chargée positivement et l'autre chargée négativement, attirant les ions correspondants de l'électrolyte et les forçant à réagir.
L'objectif fondamental : forcer une réaction non spontanée
L'objectif principal de la cellule est de surmonter la stabilité naturelle d'un composé. C'est la différence clé entre une cellule électrolytique et une cellule galvanique (comme une batterie standard), qui libère de l'énergie à partir d'une réaction spontanée.
Surmonter la stabilité chimique
Une réaction non spontanée est celle qui nécessite un apport net d'énergie pour se produire. Pensez-y comme pousser un rocher en montée – cela ne se produira pas tout seul. L'énergie électrique fournie à la cellule d'électrolyse fournit la force nécessaire pour pousser ce « rocher chimique » en montée, brisant les liaisons chimiques fortes.
La signification de l'électrolyse
Le nom lui-même explique la fonction. Il vient d'« électro », faisant référence à l'électricité, et du mot grec « lyse », signifiant briser ou décomposer. La cellule utilise l'électricité pour décomposer un composé.
Comprendre les considérations pratiques
Bien que puissante, l'électrolyse n'est pas sans exigences ni limites. Son application est un choix d'ingénierie délibéré basé sur des compromis spécifiques.
Le besoin d'énergie continue
L'électrolyse est un processus énergivore. Elle nécessite un approvisionnement constant et souvent substantiel en électricité pour fonctionner. Si l'alimentation est interrompue, la réaction s'arrête immédiatement. Ce coût énergétique est un facteur principal dans la viabilité économique de l'électrolyse industrielle.
La pureté des matériaux est essentielle
La pureté de l'électrolyte est cruciale. Les impuretés peuvent entraîner des réactions secondaires indésirables, réduisant l'efficacité du processus principal et contaminant le produit final. Le choix du matériau des électrodes est également vital, car il doit résister à l'environnement corrosif et ne pas interférer avec la réaction souhaitée.
Applications clés de l'électrolyse
L'application appropriée dépend entièrement de votre objectif final. La polyvalence de l'électrolyse en fait une pierre angulaire de la chimie et de l'industrie modernes.
- Si votre objectif principal est la production de gaz de haute pureté : L'électrolyse est la méthode standard pour décomposer l'eau (H₂O) en hydrogène et en oxygène d'une pureté exceptionnelle.
- Si votre objectif principal est l'extraction et le raffinage des métaux : Le processus est indispensable pour produire des métaux très réactifs comme l'aluminium à partir de son minerai (bauxite) ou pour affiner le cuivre à haute pureté.
- Si votre objectif principal est le revêtement et la protection des surfaces : Un processus électrolytique similaire, connu sous le nom de galvanoplastie, est utilisé pour déposer une fine couche d'un métal (comme le chrome ou l'or) sur un autre pour la résistance à la corrosion ou l'attrait esthétique.
En fin de compte, la cellule d'électrolyse est un outil fondamental pour convertir l'énergie électrique en changements chimiques précieux, nous permettant de créer des substances que la nature ne produirait pas d'elle-même.
Tableau récapitulatif :
| Composant | Rôle dans la cellule d'électrolyse |
|---|---|
| Source d'alimentation externe | Fournit l'énergie électrique pour forcer une réaction non spontanée. |
| Électrolyte | Un milieu contenant des ions qui complète le circuit électrique interne. |
| Électrodes (Anode et Cathode) | Sites où se produit la décomposition chimique, attirant les ions pour réagir. |
| Applications clés | Extraction de métaux (ex. : aluminium), production de gaz (ex. : hydrogène) et galvanoplastie. |
Prêt à améliorer les capacités de votre laboratoire avec des équipements de précision ? Chez KINTEK, nous nous spécialisons dans la fourniture d'équipements et de consommables de laboratoire de haute qualité adaptés aux processus exigeants comme l'électrolyse. Que vous raffiniez des métaux, produisiez des gaz de haute pureté ou réalisiez de la galvanoplastie, nos outils fiables garantissent efficacité et précision. Contactez-nous dès aujourd'hui pour découvrir comment KINTEK peut répondre aux besoins uniques de votre laboratoire et faire progresser vos innovations chimiques !
Guide Visuel
Produits associés
- Cellule électrochimique électrolytique en quartz pour expériences électrochimiques
- Cellule électrolytique optique à double couche de type H avec bain-marie
- Cellule de diffusion de gaz électrolytique électrochimique à flux liquide
- Cellule à flux personnalisable pour la réduction du CO2 pour la recherche sur le NRR, l'ORR et le CO2RR
- Boîtier de pile Li-Air pour applications de laboratoire de piles
Les gens demandent aussi
- Quelles sont les procédures et les observations nécessaires lors d'une expérience avec une cellule électrolytique à plaque plane pour la corrosion ? Maîtriser la méthode en 3 phases
- Quels matériaux sont utilisés pour le corps d'une cellule électrolytique optique ? Choisissez le bon matériau pour votre expérience
- Comment prévenir la contamination expérimentale lors de l'utilisation d'une cellule électrolytique en acrylique ? Maîtriser un protocole systématique pour des résultats impeccables
- Quelles sont les fonctions principales d'une cellule électrolytique haute performance dans le processus eCO2R ? Optimisez les résultats de votre laboratoire
- Comment une cellule électrolytique à oxyde solide (SOEC) atteint-elle une efficacité énergétique plus élevée ? Libérez une production d'hydrogène supérieure
- Quel est le rôle principal d'un système de cellule électrolytique à trois électrodes ? Obtenir la précision dans l'oxydation des semi-conducteurs
- Comment les appareils de gravure électrolytique sont-ils utilisés pour caractériser les aciers inoxydables duplex ? Maîtriser l'analyse microstructurale
- Quel est l'objectif de la combinaison d'une ECS avec un capillaire de Luggin ? Minimiser la chute ohmique pour des tests électrochimiques précis



















