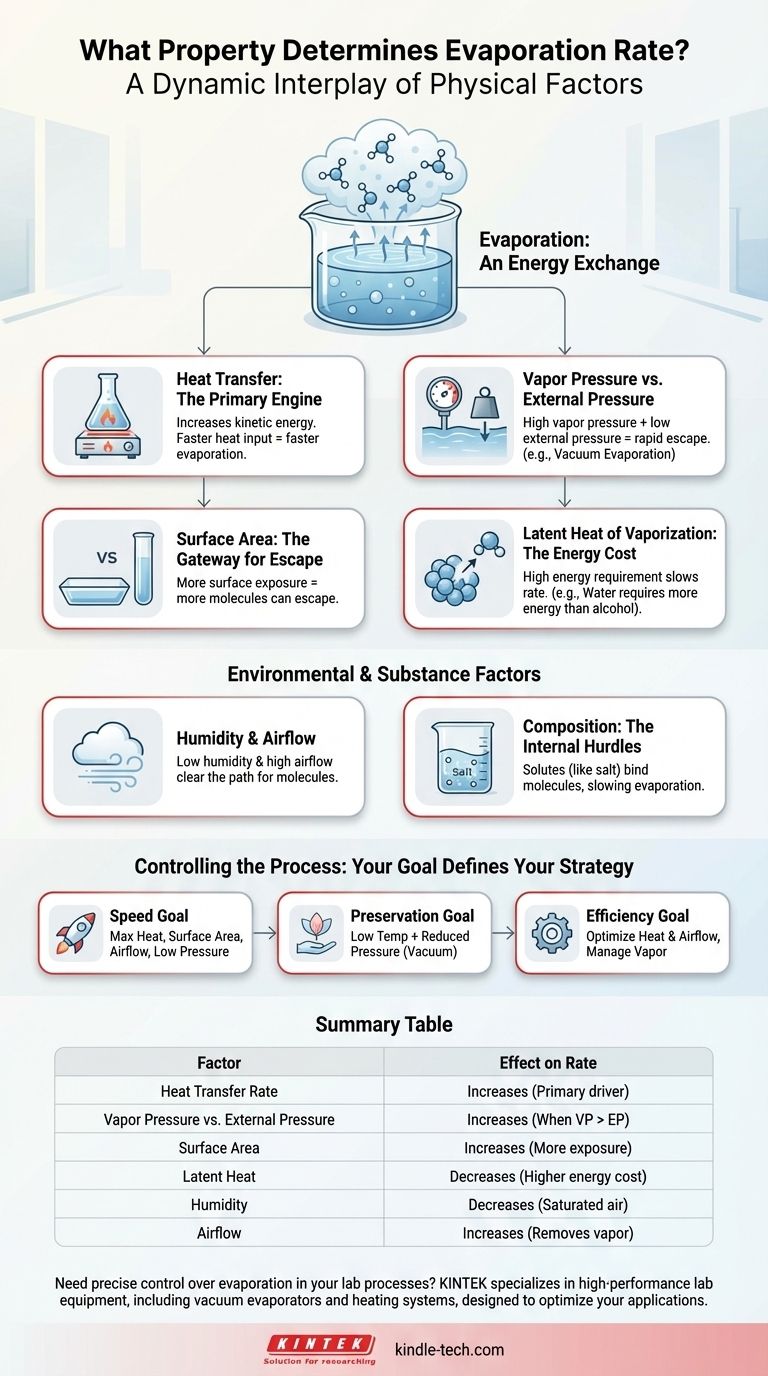
L'évaporation n'est pas régie par une seule propriété, mais plutôt par une interaction dynamique de plusieurs facteurs physiques clés. Le taux est fondamentalement déterminé par la vitesse du transfert de chaleur dans le liquide, la pression au-dessus de sa surface et l'énergie intrinsèque nécessaire pour transformer le liquide en gaz.
Le principe fondamental est un échange d'énergie : l'évaporation s'accélère lorsque l'énergie est ajoutée à un liquide plus rapidement que l'environnement ambiant ne peut résister à l'échappement de ses molécules. Comprendre comment manipuler la chaleur, la pression et la surface vous donne un contrôle direct sur ce processus.

Les principaux moteurs de l'évaporation
Pour vraiment comprendre le taux d'évaporation, nous devons examiner les forces physiques en jeu. Ces facteurs agissent de concert pour encourager ou entraver l'échappement des molécules de la surface d'un liquide.
Transfert de chaleur : le moteur principal
Le facteur le plus important est le taux auquel l'énergie thermique est fournie au liquide. La chaleur augmente l'énergie cinétique des molécules du liquide.
Lorsqu'une molécule acquiert suffisamment d'énergie cinétique pour vaincre les forces intermoléculaires qui la retiennent à ses voisines, elle s'échappe de la surface sous forme de gaz. Par conséquent, un taux plus élevé de transfert de chaleur se traduit directement par un taux d'évaporation plus rapide.
Pression de vapeur et pression externe : la bataille à la surface
Chaque liquide exerce une pression de vapeur, qui est la force de ses molécules poussant pour s'échapper dans la phase gazeuse. Ceci est contré par la pression externe (généralement la pression atmosphérique) qui s'exerce sur la surface du liquide.
L'évaporation se produit rapidement lorsque la pression de vapeur est élevée par rapport à la pression externe. C'est pourquoi l'eau s'évapore plus rapidement en haute altitude où la pression atmosphérique est plus faible.
Chaleur latente de vaporisation : le coût énergétique
La chaleur latente de vaporisation est la quantité spécifique d'énergie requise pour convertir une unité d'une substance du liquide au gaz sans changer sa température.
Les substances ayant une chaleur latente de vaporisation élevée, comme l'eau, nécessitent plus d'apport énergétique pour évaporer chaque kilogramme. Cela agit comme un frein sur le taux d'évaporation par rapport aux liquides comme l'alcool, qui ont un coût énergétique inférieur.
Surface : la porte de sortie
L'évaporation est un phénomène de surface. Seules les molécules à la surface ou à proximité peuvent s'échapper.
En augmentant la surface — par exemple, en étalant une flaque d'eau — vous exposez plus de molécules à l'air, créant plus d'opportunités pour elles de s'échapper. Cela augmente considérablement le taux d'évaporation global.
Facteurs environnementaux et spécifiques à la substance
Au-delà de la physique de base, l'environnement immédiat et la composition du liquide ajoutent une autre couche de contrôle.
Humidité et flux d'air : dégager le chemin
La quantité de vapeur déjà présente dans l'air ambiant, connue sous le nom d'humidité, affecte le taux net d'évaporation. Si l'air est déjà saturé, il y a moins de « place » pour les nouvelles molécules d'eau, ce qui ralentit le processus.
Le flux d'air (vent) balaie la couche d'air humide directement au-dessus de la surface du liquide, la remplaçant par de l'air plus sec. Cela maintient un gradient de concentration raide et encourage davantage de molécules à s'échapper.
Composition de la substance : les obstacles internes
La présence de solutés, comme le sel ou le sucre dans l'eau, peut ralentir l'évaporation. Ces particules dissoutes forment des liaisons avec les molécules d'eau, nécessitant plus d'énergie pour les séparer.
C'est pourquoi l'eau de mer s'évapore plus lentement que l'eau douce dans des conditions identiques. Les propriétés de la substance elle-même, et tout changement qu'elle subit, sont un facteur critique.
Comprendre les compromis
La manipulation de ces facteurs implique souvent d'équilibrer des priorités concurrentes, en particulier dans les applications industrielles ou culinaires.
Le lien entre pression et température
La réduction de la pression abaisse le point d'ébullition d'un liquide. Cette relation puissante permet une évaporation rapide à des températures bien inférieures à celles qui seraient autrement nécessaires.
Cette technique, connue sous le nom d'évaporation sous vide, est essentielle pour concentrer des substances sensibles à la chaleur, telles que le lait ou les jus de fruits, sans les brûler ou les dégrader.
La limite de l'apport de chaleur
Bien que l'ajout de chaleur soit le moyen le plus rapide d'augmenter l'évaporation, il existe souvent une température maximale admissible.
Dépasser cette limite peut provoquer des réactions chimiques indésirables, une brûlure ou une décomposition du produit. L'objectif est souvent de trouver le taux de transfert de chaleur le plus élevé possible qui ne compromette pas l'intégrité de la substance.
Comment contrôler l'évaporation pour votre objectif
Votre stratégie pour gérer l'évaporation dépend entièrement du résultat souhaité.
- Si votre objectif principal est la vitesse : Maximisez le taux d'apport de chaleur, augmentez la surface, assurez un flux d'air constant et, si possible, réduisez la pression ambiante.
- Si votre objectif principal est la préservation de la substance : Utilisez une température plus basse combinée à une pression réduite pour obtenir une évaporation sans dommage thermique.
- Si votre objectif principal est l'efficacité énergétique : Concentrez-vous sur l'optimisation du transfert de chaleur et la gestion du flux d'air pour éliminer la vapeur saturée, évitant ainsi le gaspillage d'énergie.
En fin de compte, contrôler l'évaporation est un processus de gestion du flux d'énergie entrant et sortant d'un système.
Tableau récapitulatif :
| Facteur | Effet sur le taux d'évaporation | Principe clé |
|---|---|---|
| Taux de transfert de chaleur | Augmente | Moteur principal ; ajoute de l'énergie cinétique aux molécules. |
| Pression de vapeur par rapport à la pression externe | Augmente lorsque la pression de vapeur > pression externe | Les molécules s'échappent plus facilement lorsque la pression externe est plus faible. |
| Surface | Augmente | Plus de molécules sont exposées à la surface, permettant leur échappement. |
| Chaleur latente de vaporisation | Diminue pour les substances à chaleur latente élevée | Un coût énergétique plus élevé par molécule ralentit le taux. |
| Humidité | Diminue | L'air saturé réduit le gradient de concentration pour l'échappement. |
| Flux d'air | Augmente | Élimine la vapeur saturée, maintenant un gradient de concentration raide. |
Besoin d'un contrôle précis de l'évaporation dans vos processus de laboratoire ? KINTEK est spécialisée dans les équipements de laboratoire haute performance, y compris les évaporateurs sous vide et les systèmes de chauffage conçus pour optimiser le transfert de chaleur, la pression et la surface pour vos applications spécifiques — que vous concentriez des échantillons sensibles à la chaleur ou maximisiez le débit. Laissez nos experts vous aider à sélectionner la bonne solution pour améliorer l'efficacité et préserver l'intégrité de l'échantillon. Contactez KINTEK dès aujourd'hui pour discuter de vos besoins en matière d'évaporation en laboratoire !
Guide Visuel
Produits associés
- Lyophilisateur de laboratoire de paillasse pour usage en laboratoire
- Autoclave de laboratoire stérilisateur à vide pulsé, stérilisateur à vapeur de bureau
- Stérilisateur automatique de laboratoire d'affichage numérique portable Autoclave de laboratoire pour la stérilisation sous pression
- Autoclave de laboratoire portable à haute pression pour stérilisation à la vapeur à usage en laboratoire
- Autoclave à vapeur haute pression de laboratoire vertical pour service de laboratoire
Les gens demandent aussi
- Qu'est-ce que la méthode du faisceau d'électrons ? Un guide pour le revêtement, la découpe et la stérilisation de précision
- Quels matériaux sont utilisés dans les techniques d'évaporation ? Un guide des matériaux de dépôt en couches minces
- Qu'est-ce que l'évaporation et la pulvérisation cathodique ? Choisissez la bonne méthode PVD pour vos besoins en couches minces
- Quelle est la source du faisceau d'électrons ? Choisir le bon émetteur pour votre application
- Quelle est la limitation du processus de pulvérisation cathodique ? Inconvénients majeurs dans le dépôt de couches minces
- L'évaporation assistée par faisceau d'électrons est-elle utilisée pour les métaux ? La clé des films métalliques de haute pureté et à point de fusion élevé
- Où la déposition physique en phase vapeur est-elle utilisée ? Amélioration des surfaces pour l'aérospatiale, l'électronique et plus encore
- Quels matériaux sont utilisés dans l'évaporation par faisceau d'électrons ? Des métaux purs aux céramiques haute température



















