Table des matières
Introduction aux cellules électrochimiques
Les cellules électrochimiques sont au cœur du stockage et de la conversion de l'énergie. Elles exploitent les réactions chimiques pour générer de l'électricité ou utilisent l'électricité pour entraîner des réactions chimiques. Ces cellules sont des composants essentiels de divers systèmes électrochimiques, notamment les batteries, les piles à combustible et la galvanoplastie, et sont indispensables aux progrès des technologies énergétiques, des véhicules électriques et de l'ingénierie électrochimique.
Types de cellules électrochimiques
Les cellules électrochimiques sont des dispositifs qui convertissent l'énergie chimique en énergie électrique (cellules voltaïques) ou inversement (cellules électrolytiques). Elles se composent de deux électrodes, une cathode et une anode, immergées dans une solution électrolytique.
Cellules voltaïques
Également appelées cellules galvaniques, les cellules voltaïques produisent de l'électricité à partir de réactions chimiques spontanées. Dans une cellule voltaïque, l'anode est l'électrode négative où se produit l'oxydation, qui libère des électrons. Ces électrons circulent dans un circuit externe jusqu'à la cathode, l'électrode positive, où se produit la réduction. La nature spontanée de la réaction entraîne le flux d'électrons et génère un courant électrique.
Cellules électrolytiques
Les cellules électrolytiques, quant à elles, utilisent l'électricité pour entraîner des réactions chimiques non spontanées. Dans une cellule électrolytique, la cathode est l'électrode négative où se produit la réduction, et l'anode est l'électrode positive où se produit l'oxydation. Une source d'énergie externe fournit l'énergie électrique nécessaire pour forcer la réaction non spontanée à se produire.
Principales différences
Les principales différences entre les cellules voltaïques et électrolytiques sont les suivantes :
- La spontanéité : Les cellules voltaïques produisent de l'électricité à partir de réactions spontanées, tandis que les cellules électrolytiques nécessitent une énergie externe pour entraîner des réactions non spontanées.
- Direction du flux d'électrons : Dans les cellules voltaïques, les électrons circulent de l'anode à la cathode à travers le circuit externe. Dans les cellules électrolytiques, les électrons circulent de la cathode vers l'anode à travers le circuit externe.
- Applications : Les cellules voltaïques sont utilisées dans les batteries, les cellules solaires et d'autres dispositifs qui produisent de l'électricité. Les cellules électrolytiques sont utilisées dans la galvanoplastie, l'affinage des métaux et d'autres processus industriels.
Composants des cellules électrochimiques
Les cellules électrochimiques sont généralement constituées des éléments suivants :
- Électrodes : La cathode et l'anode sont constituées de matériaux conducteurs (métaux, graphite, etc.).
- Électrolyte : Une solution ou un sel fondu qui conduit les ions, permettant la circulation du courant entre les électrodes.
- Séparateur : Une barrière poreuse qui empêche les électrodes de se toucher directement mais permet aux ions de passer.
Informations complémentaires
- Le potentiel de cellule, ou tension, d'une cellule électrochimique est une mesure de la force motrice de la réaction. Dans les cellules voltaïques, le potentiel de la cellule est positif, ce qui indique une réaction spontanée. Dans les cellules électrolytiques, le potentiel de la cellule est négatif, ce qui indique une réaction non spontanée.
- L'efficacité d'une cellule électrochimique est déterminée par des facteurs tels que les matériaux des électrodes, la concentration de l'électrolyte et la température.
- Les cellules électrochimiques jouent un rôle crucial dans diverses applications technologiques, notamment le stockage de l'énergie, la synthèse chimique et l'assainissement de l'environnement.
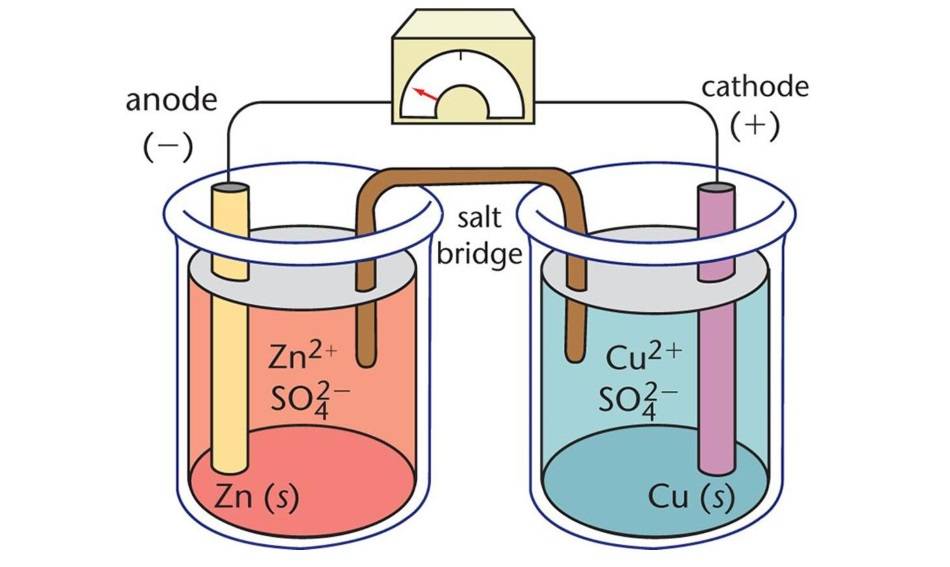
Composants des cellules électrolytiques
Les cellules électrolytiques, un type de cellule électrochimique, sont des dispositifs qui utilisent l'énergie électrique pour entraîner des réactions chimiques non spontanées. Elles se composent de trois éléments principaux : l'anode, la cathode et l'électrolyte.
L'anode
L'anode sert d'électrode négative dans une cellule électrolytique. Au cours de la réaction électrochimique, l'anode libère des électrons dans le circuit externe et subit une oxydation. En d'autres termes, c'est à l'anode que se produisent la perte d'électrons et l'oxydation.
Cathode
La cathode, quant à elle, joue le rôle d'électrode positive. Elle acquiert des électrons du circuit externe et est réduite au cours de la réaction électrochimique. C'est donc à la cathode que se produisent le gain d'électrons et la réduction.
Électrolyte
L'électrolyte est une substance qui contient des ions mobiles lorsqu'elle est dissoute dans un solvant ou fondue. Dans les cellules électrolytiques, l'électrolyte sert de support au flux d'ions entre l'anode et la cathode, complétant ainsi le circuit électrique. Les électrolytes courants comprennent les solutions aqueuses de sels et les sels fondus.
Principales différences avec les cellules galvaniques
Les cellules électrolytiques diffèrent des cellules galvaniques sur plusieurs points essentiels :
- Réactions cellulaires : Les cellules électrolytiques ont besoin d'une source externe d'énergie électrique pour entraîner des réactions non spontanées, alors que les cellules galvaniques génèrent de l'énergie électrique à partir de réactions spontanées.
- Flux d'énergie : Les cellules électrolytiques consomment de l'énergie électrique pour favoriser les réactions non spontanées, tandis que les cellules galvaniques convertissent l'énergie chimique en énergie électrique.
- Charges des électrodes : Dans les cellules électrolytiques, l'anode est négative et la cathode est positive, tandis que dans les cellules galvaniques, l'anode est positive et la cathode est négative.
Fonctionnement d'une cellule électrolytique
Le fonctionnement d'une cellule électrolytique comprend les étapes suivantes :
- Une source d'énergie externe (par exemple, une batterie) est connectée aux électrodes de la cellule électrolytique.
- La source d'énergie fournit l'énergie électrique qui entraîne la réaction non spontanée.
- À l'anode, l'oxydation se produit, libérant des électrons dans le circuit externe.
- Les électrons circulent dans le circuit externe jusqu'à la cathode.
- À la cathode, une réduction se produit, consommant les électrons du circuit externe.
- Les ions de l'électrolyte migrent pour maintenir la neutralité électrique, complétant ainsi le circuit.
Applications des cellules électrolytiques
Les cellules électrolytiques ont de nombreuses applications pratiques, notamment
- La galvanoplastie : Dépôt d'une fine couche de métal sur une surface à des fins de décoration ou de protection.
- Électrolyse de l'eau : Production d'hydrogène et d'oxygène à partir de l'eau, utilisés dans les piles à combustible et d'autres applications.
- Production de produits chimiques : Synthèse de divers produits chimiques, tels que le chlore, l'hydroxyde de sodium et l'aluminium.
- Affinage des métaux : Purification des métaux en éliminant les impuretés par électrolyse.

Potentiels d'électrodes et réactions d'oxydoréduction
Les cellules électrochimiques facilitent les réactions d'oxydo-réduction (redox). Ces cellules se présentent sous deux formes : les cellules galvaniques (voltaïques), où se produisent des réactions spontanées, et les cellules électrolytiques, où se produisent des réactions non spontanées.
Dans les cellules électrochimiques, la réaction d'oxydation a lieu à l'anode (borne négative), tandis que la réaction de réduction a lieu à la cathode (borne positive). Dans les cellules électrolytiques, l'anode attire les anions, ce qui la rend positive, tandis que dans les cellules galvaniques, l'anode est négative en raison de la libération d'électrons par la réaction d'oxydation spontanée.
La direction du flux d'électrons et la spontanéité des réactions d'oxydoréduction sont déterminées par le potentiel de l'électrode, qui est la différence de potentiel entre les électrodes. L'électrode standard à hydrogène (SHE) sert de point de référence, avec une tension de 0 volt.
Le potentiel de la cellule, qui peut être prédit à l'aide des potentiels des électrodes, fournit une estimation du potentiel mesuré. Pour calculer le potentiel de la cellule, les équations de la réaction de la demi-cellule doivent être équilibrées et la différence de tension entre les potentiels des électrodes doit être déterminée.
La cathode et l'anode jouent des rôles distincts dans les cellules électrochimiques :
Cathode :
- Signe positif dû à la consommation d'électrons
- La réaction de réduction se produit
- Les électrons pénètrent dans la cellule.
Anode :
- Signe négatif dû à la libération d'électrons
- La réaction d'oxydation se produit
- Les électrons sortent
Par convention, la cathode est représentée à droite, tandis que l'anode est représentée à gauche lorsqu'il s'agit d'une cellule électrochimique.
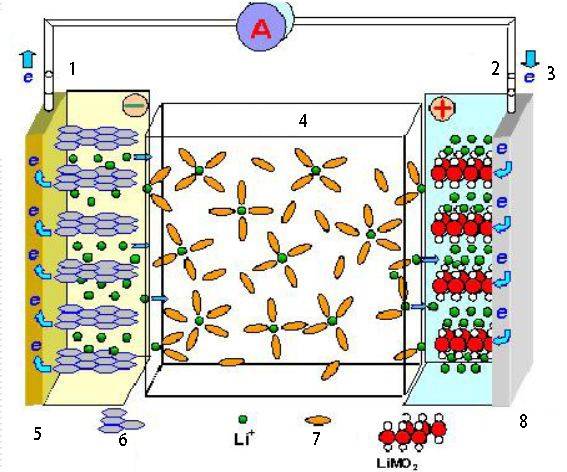
Applications des cellules électrochimiques
Les cellules électrochimiques ont un large éventail d'applications dans divers domaines, notamment le stockage et la conversion de l'énergie, ainsi que les processus industriels.
Placage électrolytique
La galvanoplastie est un procédé qui utilise des cellules électrochimiques pour appliquer une fine couche de métal à la surface d'un autre métal. Ce procédé améliore les propriétés du métal de base, telles que la résistance à la corrosion, à l'abrasion et à l'usure. La galvanoplastie est largement utilisée dans les secteurs de l'automobile, de l'électronique et de la bijouterie, à des fins fonctionnelles et esthétiques.
Piles
Les piles électrochimiques constituent la base des batteries, qui sont des composants essentiels de nombreux appareils et dispositifs électroniques. Les batteries stockent l'énergie chimique et la convertissent en énergie électrique en cas de besoin. Elles sont essentielles pour alimenter les appareils portables, tels que les smartphones, les ordinateurs portables et les véhicules électriques.
L'extraction électrolytique et l'affinage électrolytique
Les cellules électrochimiques sont utilisées dans les processus d'extraction électrolytique et d'affinage électrolytique pour produire et purifier les métaux. L'électro-extraction consiste à extraire les métaux des minerais ou d'autres sources par électrolyse, tandis que l'électro-affinage purifie davantage les métaux en éliminant les impuretés. Ces procédés sont essentiels pour obtenir des métaux de grande pureté, tels que le cuivre, le zinc et l'aluminium, qui sont indispensables à diverses applications industrielles.
Autres applications
Les cellules électrochimiques trouvent également des applications dans divers autres domaines :
- Traitement de l'eau : Elles sont utilisées dans l'électrolyse de l'eau pour produire de l'hydrogène et de l'oxygène gazeux, qui sont essentiels pour les piles à combustible et d'autres processus industriels.
- Piles à combustible : Les cellules électrochimiques sont les principaux composants des piles à combustible, qui produisent de l'électricité par des réactions électrochimiques impliquant de l'hydrogène et de l'oxygène.
- Synthèse chimique : Les cellules électrochimiques peuvent être utilisées dans les processus de synthèse chimique pour produire divers produits chimiques et matériaux.
- Capteurs et biocapteurs : Les cellules électrochimiques sont utilisées dans les capteurs et les biocapteurs pour détecter et analyser des substances spécifiques en fonction de leurs propriétés électrochimiques.

Conclusion
Les cellules électrochimiquesLes cellules électrochimiques, avec leur capacité à convertir l'énergie chimique en énergie électrique et vice versa, sont des outils indispensables dans divers domaines. Elles sont à la base du stockage et de la conversion de l'énergie, ainsi que de nombreux processus industriels. Des batteries qui alimentent nos appareils aux piles à combustible qui produisent de l'énergie propre, les cellules électrochimiques continuent de façonner les avancées technologiques. Il est essentiel de comprendre leurs principes et leurs applications pour continuer à innover dans les technologies de l'énergie, les solutions durables et l'ingénierie électrochimique.
Produits associés
- Cellule électrolytique de type H Triple Cellule électrochimique
- Cellule de diffusion de gaz électrolytique électrochimique à flux liquide
- Cellule électrochimique électrolytique pour l'évaluation des revêtements
- Cellule électrolytique électrochimique optique à fenêtre latérale
- Cellule électrochimique électrolytique en quartz pour expériences électrochimiques
Articles associés
- Le Dialogue Silencieux : Maîtriser le Contrôle dans les Cellules Électrolytiques
- Applications de la cellule électrolytique de type H dans l'extraction des métaux
- Applications des cellules électrolytiques dans la purification et la galvanoplastie
- L'art de la résistance : Pourquoi votre cellule électrolytique a besoin d'espace pour respirer
- Électrochimie La science derrière les cellules électrochimiques




















