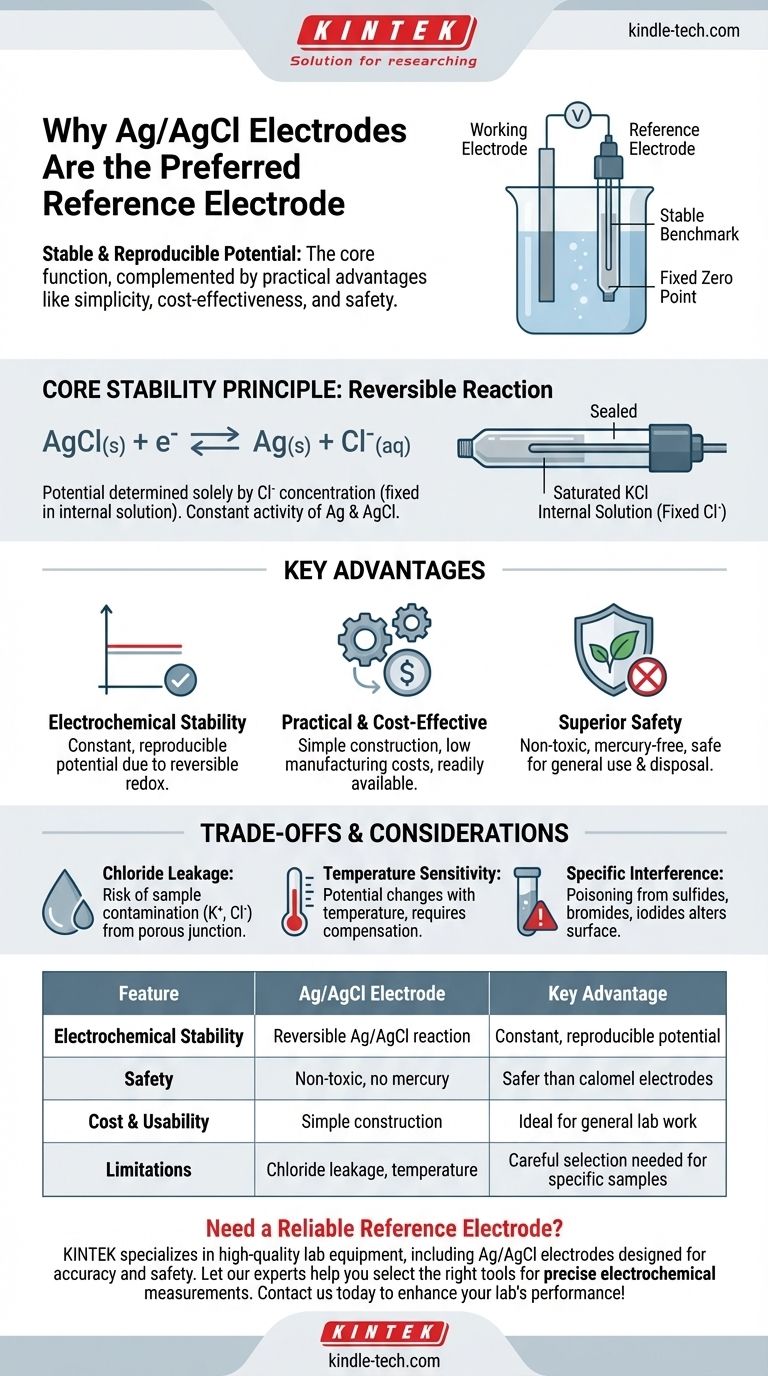
En bref, l'électrode argent/chlorure d'argent (Ag/AgCl) est utilisée comme électrode de référence car elle fournit un potentiel électrique très stable et reproductible. Cette fonction essentielle est complétée par ses avantages pratiques, notamment sa simplicité de construction, son faible coût et sa toxicité considérablement réduite par rapport aux alternatives plus anciennes comme l'électrode au calomel.
Le rôle principal d'une électrode de référence est d'être un repère stable et immuable. L'électrode Ag/AgCl excelle dans cette tâche électrochimique tout en étant sûre, abordable et facile à utiliser, ce qui en fait le choix dominant en électrochimie moderne.

Pourquoi la stabilité est la pierre angulaire d'une électrode de référence
L'exigence fondamentale : un potentiel constant
Une électrode de référence agit comme un "point zéro" fixe dans une cellule électrochimique. Toutes les autres variations de potentiel de l'électrode de travail sont mesurées par rapport à cette ligne de base stable.
Pour qu'une mesure soit précise, le potentiel de l'électrode de référence ne doit pas dériver ou changer pendant l'expérience. Il doit être insensible à la composition de la solution échantillon qu'il mesure.
Le principe d'une réaction réversible
Cette stabilité est obtenue grâce à une réaction électrochimique bien définie et réversible. Dans l'électrode Ag/AgCl, le potentiel est déterminé uniquement par la concentration des ions chlorure (Cl⁻) dans sa solution de remplissage interne.
Comme cette solution interne est scellée et a une concentration fixe (généralement du chlorure de potassium saturé), le potentiel d'électrode résultant est exceptionnellement constant et reproductible.
Comment l'électrode Ag/AgCl répond aux critères clés
Stabilité électrochimique
L'électrode Ag/AgCl est basée sur une réaction redox simple, rapide et réversible :
AgCl(s) + e⁻ ⇌ Ag(s) + Cl⁻(aq)
Puisque les activités de l'argent solide (Ag) et du chlorure d'argent (AgCl) sont constantes, le potentiel ne dépend que de l'activité de l'ion chlorure, qui est maintenue constante à l'intérieur du corps de l'électrode.
Avantages pratiques par rapport aux alternatives
L'adoption généralisée de l'électrode Ag/AgCl est également due à ses avantages pratiques significatifs. Sa fabrication est simple, ce qui entraîne des coûts faibles pour les électrodes commerciales.
Profil de sécurité supérieur
De manière cruciale, elle est non toxique. Cela lui confère un avantage majeur par rapport à l'électrode au calomel saturé (ECS), autrefois courante, qui contient du mercure hautement toxique et présente des risques d'élimination et de sécurité. Pour cette raison, l'Ag/AgCl a largement remplacé les électrodes au calomel dans l'utilisation générale en laboratoire.
Comprendre les compromis et les limites
Aucune électrode n'est parfaite pour toutes les situations. Comprendre les limites de l'électrode Ag/AgCl est essentiel pour garantir des mesures précises.
Contamination par fuite de chlorure
Le problème le plus courant est la lente fuite de la solution de remplissage de KCl de la jonction poreuse de l'électrode vers l'échantillon. Cela peut contaminer les échantillons sensibles aux ions potassium (K⁺) ou chlorure (Cl⁻).
Par exemple, la mesure du chlorure dans un échantillon d'eau avec une électrode Ag/AgCl standard produirait des résultats artificiellement élevés en raison de cette fuite.
Sensibilité à la température
Le potentiel d'une électrode Ag/AgCl dépend de la température. Bien que cette relation soit prévisible, cela signifie que pour un travail de haute précision, la température doit être contrôlée ou son effet doit être compensé dans les calculs.
Interférence dans des échantillons spécifiques
L'électrode peut être "empoisonnée" si l'échantillon contient des substances qui réagissent avec l'argent, telles que des protéines avec des groupes sulfure, des ions bromure ou des ions iodure. Cette réaction altère la surface de l'électrode et provoque une dérive imprévisible du potentiel.
Faire le bon choix pour votre objectif
Lors de la sélection d'une électrode de référence, votre objectif principal dicte le meilleur choix.
- Si votre objectif principal est le travail de laboratoire général (par exemple, les mesures de pH) : L'électrode Ag/AgCl standard est le choix par défaut idéal en raison de son excellent équilibre entre stabilité, faible coût et sécurité.
- Si votre objectif principal est l'analyse d'échantillons sensibles au chlorure ou au potassium : Vous devez utiliser une électrode de référence à double jonction, qui possède une deuxième chambre externe pour empêcher la solution de KCl de contaminer votre échantillon.
- Si votre objectif principal est de travailler dans des solvants non aqueux ou à des températures élevées : Les performances d'une Ag/AgCl standard peuvent être compromises, et vous devrez peut-être rechercher des électrodes de référence spécialisées conçues pour ces conditions spécifiques.
Comprendre ces principes fondamentaux vous permet de sélectionner non seulement une électrode, mais l'outil correct pour garantir des mesures précises et fiables.
Tableau récapitulatif :
| Caractéristique | Électrode Ag/AgCl | Avantage clé |
|---|---|---|
| Stabilité électrochimique | Basée sur une réaction Ag/AgCl réversible | Fournit un potentiel constant et reproductible |
| Sécurité | Non toxique, sans mercure | Plus sûre que les électrodes au calomel |
| Coût et facilité d'utilisation | Simple à construire et peu coûteuse | Idéale pour le travail général en laboratoire |
| Limites | Risque de fuite de chlorure, sensibilité à la température | Nécessite une sélection rigoureuse pour des échantillons spécifiques |
Besoin d'une électrode de référence fiable pour votre laboratoire ? KINTEK est spécialisé dans les équipements et consommables de laboratoire de haute qualité, y compris les électrodes Ag/AgCl conçues pour la précision et la sécurité. Laissez nos experts vous aider à sélectionner les bons outils pour des mesures électrochimiques précises. Contactez-nous dès aujourd'hui pour améliorer les performances de votre laboratoire !
Guide Visuel
Produits associés
- Électrode électrochimique à disque métallique
- Électrode de référence au calomel, chlorure d'argent, sulfate de mercure pour usage en laboratoire
- Électrode électrochimique en graphite, tige et plaque de graphite
- Électrode à disque de platine rotatif pour applications électrochimiques
- Électrode à disque d'or
Les gens demandent aussi
- Quelles sont les principales caractéristiques de performance d'une électrode à disque métallique ? Assurer des mesures électrochimiques précises
- Comment manipuler une électrode à disque métallique pendant une expérience ? Assurer des mesures électrochimiques précises
- Comment un électrode à disque métallique doit-il être entretenu ? Un guide pour des données électrochimiques cohérentes et fiables
- Quel est l'objectif de la sélection d'électrodes à disque polycristallin ? Obtenir la précision dans la recherche sur la corrosion des métaux précieux
- Quels matériaux peuvent être utilisés pour les électrodes à disque métallique ? Choisir le bon métal pour votre expérience électrochimique



















