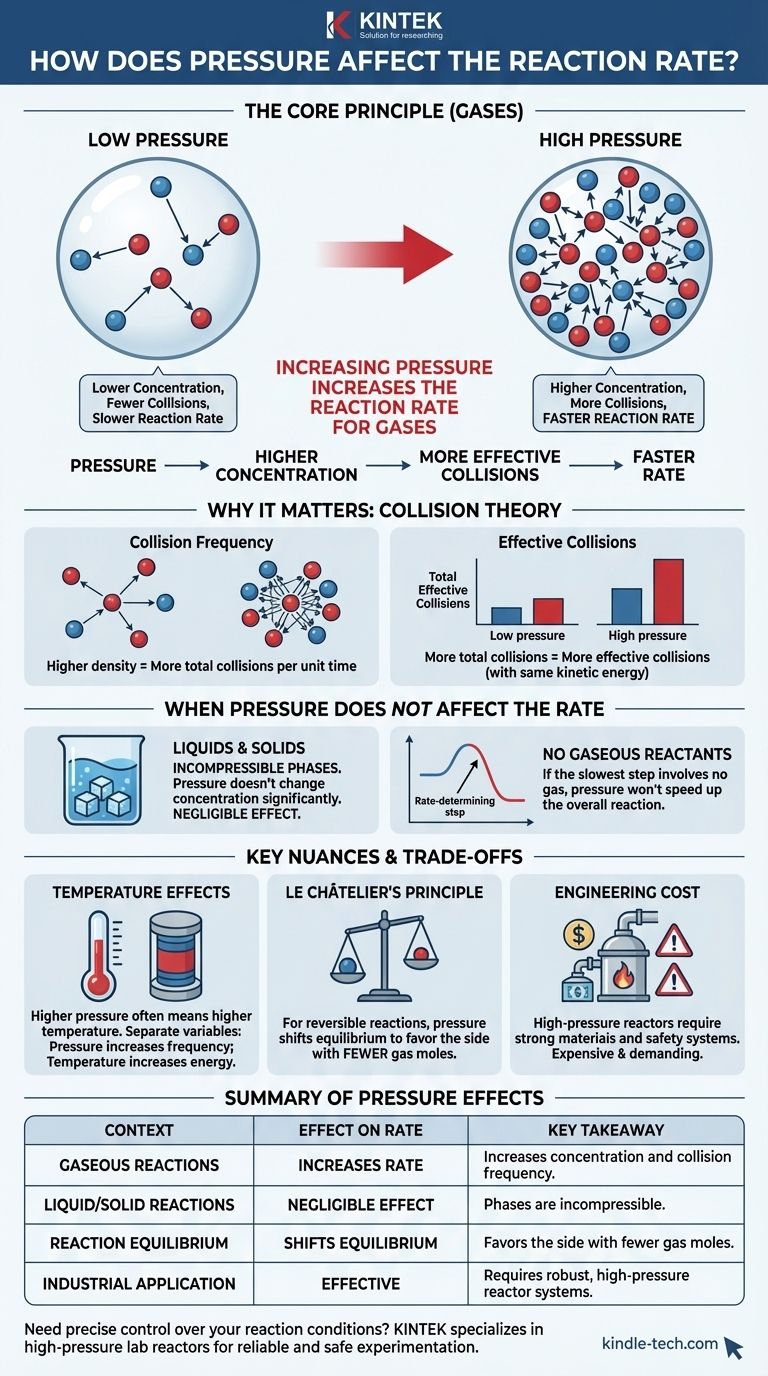
En bref, l'augmentation de la pression d'une réaction impliquant des gaz augmente la vitesse de réaction. Cela se produit parce que la pression est une mesure directe de la concentration pour les gaz. En comprimant les molécules de gaz dans un volume plus petit, vous augmentez la probabilité qu'elles entrent en collision et réagissent entre elles.
Le principe fondamental est que, pour les réactions gazeuses, la pression agit comme un levier direct sur la concentration. Une pression plus élevée rapproche les molécules de gaz, augmentant la fréquence des collisions efficaces et accélérant ainsi la réaction. Cet effet est négligeable pour les réactions en phase liquide ou solide.

Le mécanisme fondamental : pourquoi la pression est importante
Pour vraiment comprendre l'effet de la pression, nous devons revenir aux premiers principes de la façon dont les réactions chimiques se produisent. Tout tourne autour du concept de collisions entre particules.
La pression comme mesure de la concentration
Pour les gaz, la pression n'est pas une force abstraite ; c'est le résultat des molécules de gaz entrant en collision avec les parois de leur récipient.
La loi des gaz parfaits montre une relation directe entre la pression (P) et le nombre de moles (n) dans un volume donné (V) à une température constante (T). Plus il y a de molécules dans le même espace, plus la pression est élevée. Par conséquent, l'augmentation de la pression est fonctionnellement identique à l'augmentation de la concentration.
Le rôle de la théorie des collisions
Les réactions chimiques se produisent lorsque les particules réactives entrent en collision, deux conditions clés étant remplies :
- Elles doivent posséder suffisamment d'énergie cinétique pour franchir la barrière d'énergie d'activation.
- Elles doivent entrer en collision avec la bonne orientation physique.
Une collision qui satisfait ces deux critères est appelée collision efficace. La vitesse d'une réaction est déterminée par la fréquence de ces collisions efficaces.
Plus de pression = Plus de collisions
Lorsque vous augmentez la pression d'un système gazeux, vous forcez le même nombre de molécules dans un volume plus petit.
Cette densité plus élevée signifie que la distance moyenne entre les molécules diminue. Par conséquent, le nombre total de collisions entre les molécules réactives par unité de temps augmente considérablement.
L'impact sur les collisions « efficaces »
Bien que l'augmentation de la pression augmente le nombre total de collisions, elle ne modifie pas l'énergie cinétique des molécules individuelles (en supposant que la température reste constante).
Par conséquent, le pourcentage de collisions qui sont efficaces reste le même. Cependant, comme le nombre total de collisions a augmenté, le nombre absolu de collisions efficaces par seconde augmente également. C'est ce qui fait monter la vitesse de réaction.
Quand la pression n'affecte pas le taux
Le lien entre la pression et la vitesse de réaction est puissant, mais il n'est pas universel. Il est essentiel de savoir quand il ne s'applique pas.
Réactions en phases liquide et solide
Les liquides et les solides sont considérés comme des phases incompressibles. L'application d'une pression externe ne modifie pas significativement leur volume ou l'espacement entre leurs particules constituantes.
Étant donné que les changements de pression ne modifient pas la concentration des réactifs dans les liquides et les solides, la pression a un effet négligeable sur les vitesses des réactions se produisant uniquement dans ces phases.
Réactions sans réactifs gazeux
Si un mécanisme de réaction implique plusieurs étapes, la vitesse globale est déterminée par l'étape la plus lente, connue sous le nom d'étape déterminante de la vitesse.
Si cette étape déterminante de la vitesse n'implique aucun réactif gazeux, les changements de pression externe n'influenceront pas la vitesse globale de la réaction.
Comprendre les compromis et les nuances
Le contrôle de la pression est une stratégie industrielle courante, mais il comporte des considérations importantes qui vont au-delà des simples changements de vitesse.
Distinction des effets de la température
En pratique, la compression d'un gaz augmente sa température. Une pression plus élevée et une température plus élevée augmentent toutes deux les vitesses de réaction, mais pour des raisons différentes.
Il est crucial d'isoler les variables. La pression augmente la fréquence des collisions, tandis que la température augmente l'énergie et la force de ces collisions, rendant un pourcentage plus élevé d'entre elles efficaces.
Principe de Le Châtelier et équilibre
Pour les réactions réversibles qui atteignent un état d'équilibre, la pression joue un double rôle. Selon le principe de Le Châtelier, l'augmentation de la pression déplace la position d'équilibre pour favoriser le côté de la réaction comportant le moins de moles de gaz.
Ceci est un concept distinct de la cinétique (vitesse). La pression augmente la vitesse des réactions à la fois directe et inverse, mais elle peut déplacer l'équilibre final des produits et des réactifs.
Le coût d'ingénierie de la haute pression
La construction et le maintien de réacteurs à haute pression sont technologiquement exigeants et coûteux. Les matériaux doivent être suffisamment solides pour résister à la contrainte, et des systèmes de sécurité étendus sont nécessaires pour prévenir les défaillances catastrophiques. Ce compromis économique et sécuritaire est un facteur majeur dans la conception des procédés industriels.
Application à votre objectif
Votre approche de l'utilisation de la pression dépend entièrement du système chimique avec lequel vous travaillez et de ce que vous essayez d'accomplir.
- Si votre objectif principal est de maximiser la vitesse de réaction pour un processus gazeux : Augmenter la pression est une méthode directe et efficace, à condition de pouvoir gérer les changements de température et les coûts d'ingénierie associés.
- Si vous étudiez l'équilibre chimique : N'oubliez pas que la pression affecte à la fois les vitesses de réaction et la position d'équilibre finale, favorisant le côté avec moins de molécules de gaz.
- Si votre réaction n'implique que des liquides ou des solides : Changer la pression externe n'est pas une stratégie viable pour contrôler la vitesse de réaction ; concentrez-vous plutôt sur la température, la concentration ou les catalyseurs.
En comprenant le lien direct de la pression avec la concentration, vous obtenez un levier puissant pour contrôler la cinétique des réactions gazeuses.
Tableau récapitulatif :
| Effet de la pression sur la vitesse de réaction | Conclusion clé |
|---|---|
| Réactions gazeuses | Augmente la vitesse en augmentant la concentration et la fréquence des collisions. |
| Réactions liquide/solide | Effet négligeable ; les phases sont incompressibles. |
| Équilibre de réaction | Déplace l'équilibre pour favoriser le côté avec moins de moles de gaz. |
| Application industrielle | Efficace mais nécessite des systèmes de réacteurs haute pression robustes. |
Besoin d'un contrôle précis de vos conditions de réaction ? KINTEK est spécialisé dans les réacteurs de laboratoire haute pression et les équipements conçus pour une expérimentation fiable et sûre. Que vous optimisiez la vitesse de réaction gazeuse ou que vous étudiiez l'équilibre chimique, nos solutions offrent les performances et la sécurité dont vous avez besoin. Contactez nos experts dès aujourd'hui pour trouver le système parfait pour les défis uniques de votre laboratoire.
Guide Visuel
Produits associés
- Réacteurs haute pression personnalisables pour des applications scientifiques et industrielles avancées
- Réacteur Autoclave Haute Pression en Acier Inoxydable pour Laboratoire
- Mini réacteur autoclave haute pression SS pour utilisation en laboratoire
- Four à tube sous vide haute pression de laboratoire
- Réacteur Autoclave de Laboratoire Haute Pression pour Synthèse Hydrothermale
Les gens demandent aussi
- Quel est le but de l'utilisation de gaz d'argon de haute pureté dans un réacteur à haute pression ? Assurer des données précises sur les tests de corrosion
- Pourquoi les récipients de réaction de laboratoire scellés sont-ils nécessaires dans la synthèse hydrothermale des zéolithes ? Assurer la pureté et le rendement
- Quelle est la contribution d'un réacteur hydrothermique à la construction de pores gradués ? Gabarits de précision pour le TAS
- Quel est le but de l'utilisation d'un réacteur hydrothermique à haute température ? Amélioration de la synthèse de cathodes à base d'iode sur charbon actif
- Quel rôle joue un autoclave dans la simulation des conditions d'un REP ? Validation avancée des matériaux pour la sécurité nucléaire



















