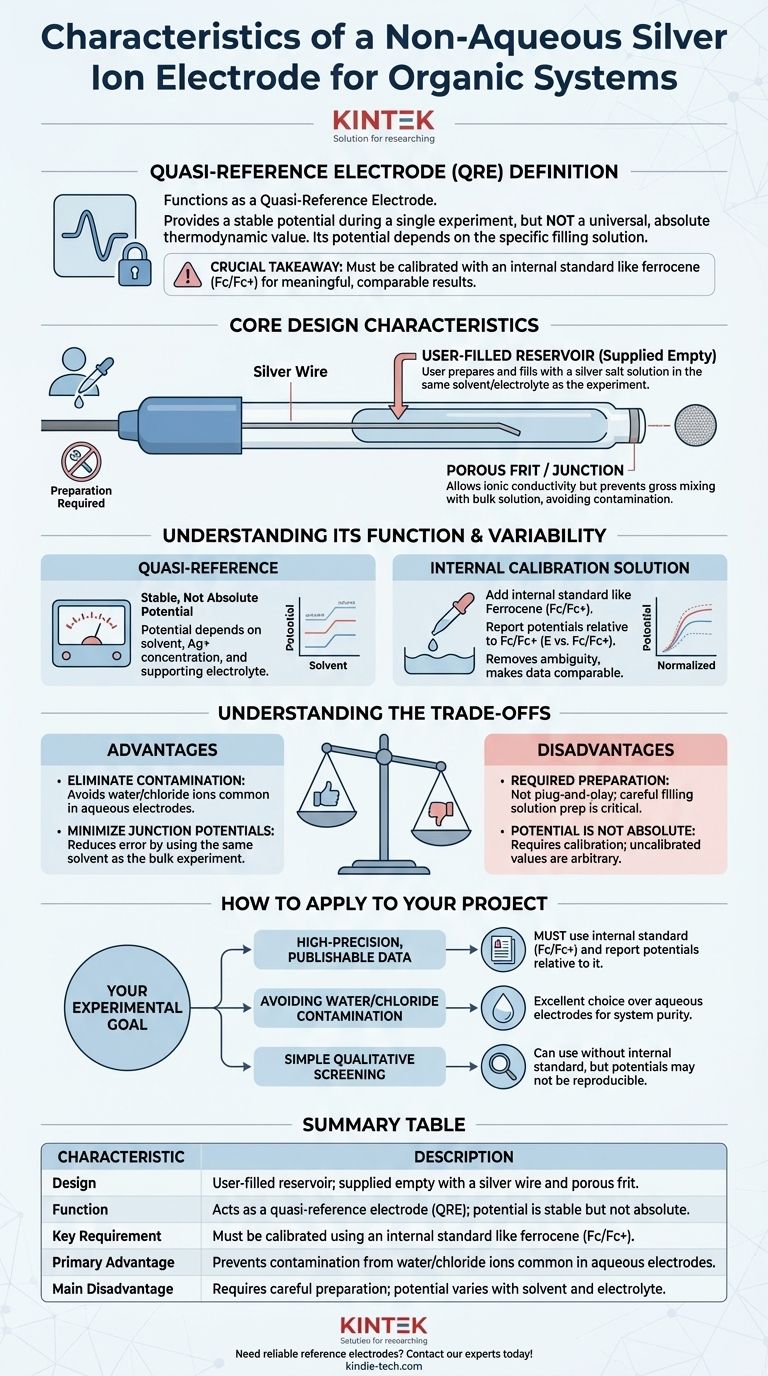
Une électrode à ions argent non aqueuse est une électrode de référence hautement spécialisée conçue spécifiquement pour les mesures électrochimiques dans les solvants organiques. Sa caractéristique principale est sa conception configurable par l'utilisateur ; elle est fournie vide, nécessitant que l'utilisateur prépare et ajoute une solution de remplissage. Cela en fait un outil flexible mais exigeant qui fournit un potentiel stable au sein d'une seule expérience, plutôt qu'un potentiel universel et absolu comme ses homologues aqueuses.
L'information cruciale est qu'une électrode à ions argent non aqueuse fonctionne comme une quasi-électrode de référence (QER). Son potentiel n'est pas fixe mais dépend de la solution de remplissage spécifique que vous préparez. Pour que les résultats soient significatifs et comparables, vous devez calibrer son potentiel lors de chaque expérience en utilisant un étalon interne comme le ferrocène.

Caractéristiques de conception principales
La nature physique et chimique unique de cette électrode dicte la manière dont elle doit être manipulée et utilisée pour garantir des mesures fiables.
Réservoir rempli par l'utilisateur
La caractéristique la plus notable est que l'électrode est fournie vide. Elle se compose d'un fil d'argent logé dans un corps en verre ou en polymère que vous devez remplir avec une solution appropriée. Il s'agit d'un choix de conception délibéré, et non d'une mesure d'économie.
Le rôle de la solution de remplissage
Vous créez le potentiel de référence en préparant une solution de remplissage, généralement une concentration connue d'un sel d'argent (par exemple, nitrate d'argent, AgNO₃, ou triflate d'argent, AgOTf) dissous dans le même solvant et contenant le même électrolyte de support que votre expérience principale. Cette préparation est l'étape la plus critique pour utiliser correctement l'électrode.
Isolation de la solution en vrac
La pointe de l'électrode est dotée d'une fritte ou d'une jonction poreuse. Cela permet une conductivité ionique entre la solution de remplissage interne et la solution en vrac dans votre cellule électrochimique, ce qui est nécessaire pour compléter le circuit électrique. Cependant, cela empêche le mélange grossier des deux solutions, ce qui contaminerait votre expérience et déstabiliserait le potentiel de référence.
Comprendre son fonctionnement en tant que quasi-électrode de référence (QER)
Le terme "quasi-électrode de référence" décrit parfaitement le comportement d'une électrode à ions argent remplie par l'utilisateur dans les systèmes organiques.
Qu'est-ce qu'une QER ?
Une QER fournit un potentiel stable pendant une seule expérience continue. Cependant, ce potentiel n'est pas basé sur une valeur thermodynamique standardisée et universellement acceptée. Il est "quasi" car sa valeur dépend entièrement de la composition et de la concentration de la solution de remplissage que vous avez préparée.
Le problème de la variabilité du potentiel
Le potentiel de votre QER Ag/Ag+ différera en fonction du solvant utilisé, de la concentration du sel d'argent et de l'électrolyte de support spécifique. Cela signifie qu'un potentiel de "+0,5 V" dans une expérience n'est pas directement comparable à "+0,5 V" dans une autre expérience si les conditions ou la solution de remplissage étaient même légèrement différentes.
La solution : l'étalonnage interne
Pour obtenir des données significatives, reproductibles et publiables, vous devez étalonner la QER in situ. Cela se fait en ajoutant une petite quantité d'un étalon interne avec un potentiel redox bien connu à votre solution d'analyte.
En électrochimie non aqueuse, le couple ferrocène/ferrocénium (Fc/Fc+) est l'étalon universellement accepté. Après votre expérience, il vous suffit de rapporter tous les potentiels mesurés par rapport au potentiel observé du couple Fc/Fc+ (E vs. Fc/Fc+). Cette pratique supprime l'ambiguïté de la QER et rend vos résultats comparables aux recherches de tout autre laboratoire.
Comprendre les compromis
L'utilisation d'une QER non aqueuse implique un ensemble clair d'avantages et d'inconvénients que vous devez peser pour votre application spécifique.
Avantage : Élimination de la contamination
La principale raison d'utiliser une électrode de référence non aqueuse est d'éviter de contaminer votre système organique sensible avec de l'eau ou des ions chlorure, qui sont inévitables lors de l'utilisation d'électrodes aqueuses standard comme Ag/AgCl ou SCE.
Avantage : Minimisation des potentiels de jonction
L'utilisation d'une solution de remplissage avec le même solvant que votre expérience en vrac réduit considérablement le potentiel de jonction liquide. Ce potentiel important, instable et inconnu, qui se forme à l'interface de deux solvants différents (par exemple, l'eau et l'acétonitrile), est une source majeure d'erreur lors de l'utilisation d'électrodes aqueuses dans des milieux organiques.
Inconvénient : Préparation requise
Cette électrode n'est pas "prête à l'emploi". Elle nécessite une préparation minutieuse de la solution de remplissage. Une solution mal préparée ou contaminée entraînera un potentiel instable et fluctuant qui invalidera toute votre mesure.
Inconvénient : Le potentiel n'est pas absolu
Comme discuté, le potentiel est seulement stable, pas absolu. Ne pas étalonner par rapport à un étalon interne comme le ferrocène signifie que vos valeurs de potentiel sont arbitraires et ne peuvent pas être comparées ou reproduites de manière fiable.
Comment appliquer cela à votre projet
L'utilisation correcte de cette électrode dépend entièrement de vos objectifs expérimentaux.
- Si votre objectif principal est d'obtenir des données de haute précision et publiables : Vous devez utiliser un étalon interne comme le ferrocène et rapporter tous les potentiels par rapport au couple redox Fc/Fc+.
- Si votre objectif principal est d'éviter la contamination par l'eau/le chlorure : Cette électrode est un excellent choix par rapport à toute alternative aqueuse, garantissant la pureté de votre système organique.
- Si votre objectif principal est un simple criblage qualitatif : Vous pouvez utiliser l'électrode sans étalon interne, mais vous devez accepter que les potentiels peuvent ne pas être parfaitement reproductibles entre les expériences.
Correctement préparée et étalonnée, l'électrode à ions argent non aqueuse est un outil indispensable pour une analyse électrochimique fiable dans les milieux organiques.
Tableau récapitulatif :
| Caractéristique | Description |
|---|---|
| Conception | Réservoir rempli par l'utilisateur ; fourni vide avec un fil d'argent et une fritte poreuse. |
| Fonction | Agit comme une quasi-électrode de référence (QER) ; le potentiel est stable mais non absolu. |
| Exigence clé | Doit être étalonnée à l'aide d'un étalon interne comme le ferrocène (Fc/Fc+). |
| Avantage principal | Empêche la contamination par l'eau/les ions chlorure courants dans les électrodes aqueuses. |
| Inconvénient principal | Nécessite une préparation minutieuse ; le potentiel varie avec le solvant et l'électrolyte. |
Besoin d'électrodes de référence fiables pour vos travaux d'électrochimie organique ? KINTEK est spécialisé dans les équipements et consommables de laboratoire de haute qualité, y compris les électrodes conçues pour des mesures précises et sans contaminants dans les systèmes non aqueux. Nos produits aident les chercheurs comme vous à obtenir des résultats précis et reproductibles. Contactez nos experts dès aujourd'hui pour trouver la solution parfaite pour les besoins de votre laboratoire !
Guide Visuel
Produits associés
- Creuset d'évaporation pour matière organique
- Électrode de référence au sulfate de cuivre pour usage en laboratoire
- Électrode auxiliaire en platine pour usage en laboratoire
- Électrode à disque rotatif (disque-anneau) RRDE / Compatible avec PINE, ALS japonais, Metrohm suisse carbone vitreux platine
- Système de chambre de dépôt chimique en phase vapeur CVD Équipement Four tubulaire PECVD avec gazéificateur liquide Machine PECVD
Les gens demandent aussi
- Quelles sont les analyses utilisées en laboratoire ? Choisissez le bon outil pour les besoins de votre laboratoire
- Les cannabinoïdes s'évaporent-ils ? Comment préserver la puissance et prévenir la dégradation
- Qu'est-ce que le dépôt en chimie environnementale ? Comprendre comment la pollution atmosphérique nuit aux écosystèmes
- Quelles précautions prendre dans un laboratoire de chimie ? Maîtrisez le cadre RAMP pour une sécurité optimale
- Quelle est la règle du delta 20 pour l'évaporation ? Maîtriser la pulvérisation sûre et efficace














