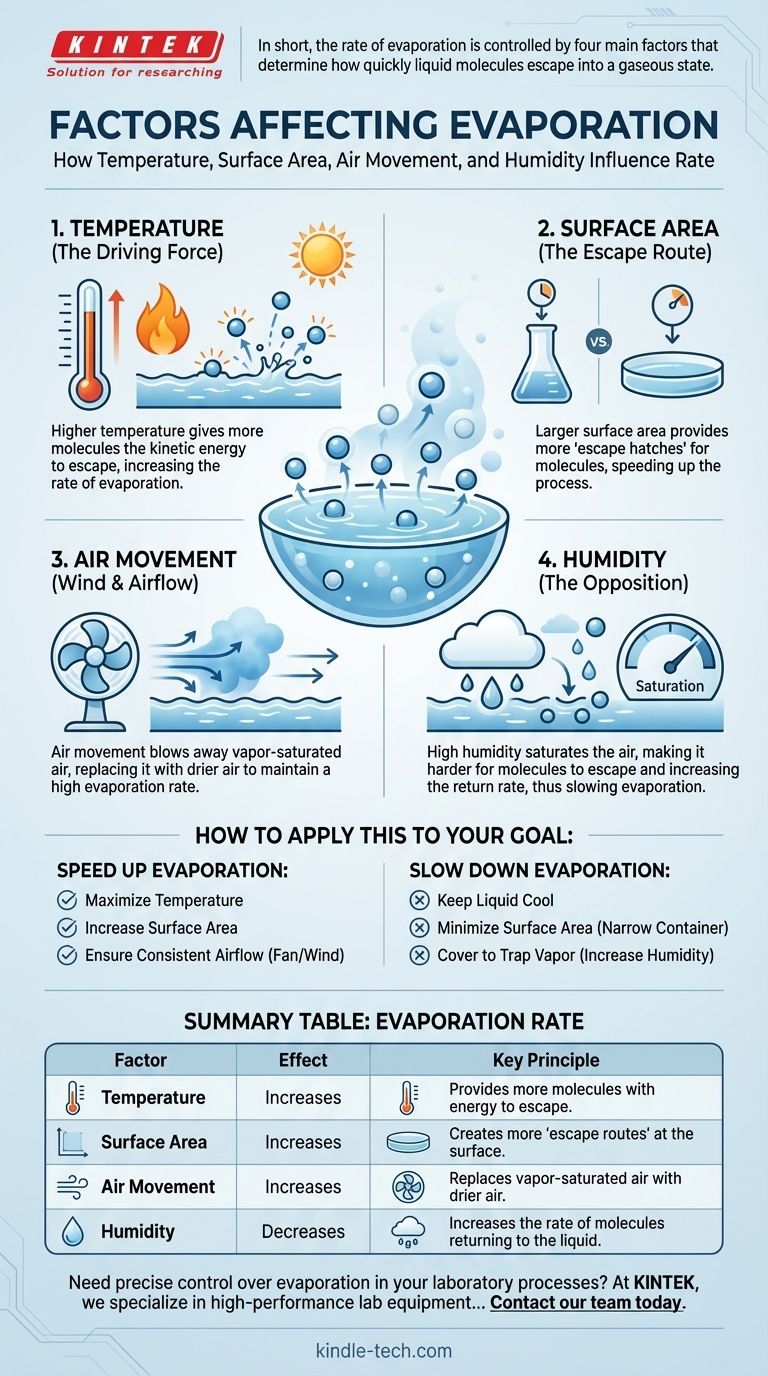
En bref, le taux d'évaporation est principalement contrôlé par quatre facteurs : la température, la surface, le mouvement de l'air et l'humidité de l'air ambiant. Ces éléments agissent ensemble pour déterminer la rapidité avec laquelle les molécules d'un liquide peuvent acquérir suffisamment d'énergie pour s'échapper et passer à l'état gazeux.
Le principe fondamental de l'évaporation est une bataille entre les molécules qui s'échappent d'un liquide et celles qui y retournent. Chaque facteur d'influence ne fait que faire pencher cet équilibre, soit en facilitant la sortie des molécules, soit en rendant leur retour plus difficile.

La force motrice : la température et l'énergie moléculaire
Au fond, l'évaporation est une question d'énergie. Le facteur qui fournit l'apport énergétique le plus direct est la température, ce qui en fait le moteur le plus critique de tout le processus.
Qu'est-ce que l'évaporation au niveau moléculaire ?
L'évaporation se produit lorsque les molécules à l'intérieur d'un liquide acquièrent suffisamment d'énergie cinétique pour vaincre les forces qui les maintiennent ensemble. Une fois qu'elles ont rompu ces liaisons, elles s'échappent de la surface et deviennent un gaz ou une vapeur.
L'impact direct de la température
La température est une mesure de l'énergie cinétique moyenne des molécules d'une substance. Lorsque vous chauffez un liquide, vous augmentez cette énergie moyenne.
Cela signifie qu'un plus grand nombre de molécules à un instant donné posséderont l'« énergie d'évasion » minimale requise pour se libérer de la surface du liquide.
Comment la température affecte le taux
Étant donné qu'une température plus élevée équipe davantage de molécules de l'énergie nécessaire pour s'échapper, elle augmente directement et significativement le taux d'évaporation. Une flaque d'eau disparaîtra beaucoup plus rapidement par une journée chaude que par une journée froide pour cette simple raison.
La voie d'évacuation : la surface et le flux d'air
Alors que la température fournit l'énergie nécessaire à l'évasion, les conditions physiques à la surface du liquide déterminent la facilité avec laquelle cette évasion peut se produire.
Pourquoi une plus grande surface est plus rapide
Seules les molécules situées à la surface d'un liquide peuvent s'évaporer. Plus la surface exposée à l'air est grande, plus il y a de « trappes d'évasion » disponibles pour les molécules à haute énergie.
Renverser un verre d'eau crée une flaque mince et large qui s'évapore rapidement. La même quantité d'eau laissée dans le verre mettra beaucoup plus de temps à s'évaporer car sa surface est bien plus petite.
Le rôle du mouvement de l'air (vent)
Lorsqu'un liquide s'évapore, l'air juste au-dessus de sa surface devient saturé de vapeur. Cela crée un micro-environnement humide qui rend plus difficile la sortie de nouvelles molécules.
Le vent ou toute forme de flux d'air balaie cet air saturé de vapeur, le remplaçant par de l'air plus sec. Cela maintient un gradient de concentration prononcé, encourageant le liquide à continuer de s'évaporer à un rythme élevé.
L'opposition : l'humidité dans l'air
L'évaporation n'est pas une rue à sens unique. Alors que les molécules s'échappent du liquide, les molécules de vapeur dans l'air se condensent également pour y retourner. Le taux net d'évaporation dépend de l'équilibre entre ces deux processus.
Comment l'humidité agit comme une barrière
L'humidité est la quantité de vapeur d'eau déjà présente dans l'air. Si l'air est déjà très saturé (humidité élevée), il y a moins de « place » pour les nouvelles molécules d'eau.
Cette forte concentration de vapeur dans l'air augmente le taux auquel les molécules retournent au liquide. Lorsque le taux de retour est égal au taux d'évasion, l'évaporation nette cesse.
L'interaction des facteurs
C'est pourquoi une journée chaude mais humide peut être si inconfortable et empêcher la transpiration de s'évaporer efficacement. Même avec des températures élevées fournissant de l'énergie, l'air saturé supprime le taux d'évaporation net. L'évaporation la plus rapide se produit les jours chauds, secs et venteux.
Comment appliquer cela à votre objectif
Comprendre ces facteurs vous permet de prédire et de contrôler le taux d'évaporation à toute fin pratique.
- Si votre objectif principal est d'accélérer l'évaporation : Maximisez la température, étalez le liquide pour augmenter la surface et utilisez un ventilateur ou le vent pour assurer un flux d'air constant.
- Si votre objectif principal est de ralentir l'évaporation : Gardez le liquide au frais, stockez-le dans un récipient avec une ouverture étroite pour minimiser la surface et couvrez-le pour piéger la vapeur et augmenter l'humidité locale.
En fin de compte, maîtriser ces principes vous donne un contrôle direct sur ce processus physique fondamental.
Tableau récapitulatif :
| Facteur | Effet sur le taux d'évaporation | Principe clé |
|---|---|---|
| Température | Augmente | Fournit à plus de molécules l'énergie nécessaire pour s'échapper. |
| Surface | Augmente | Crée plus de « voies d'évacuation » pour les molécules à la surface. |
| Mouvement de l'air | Augmente | Remplace l'air saturé de vapeur par de l'air plus sec. |
| Humidité | Diminue | Augmente le taux de retour des molécules dans le liquide. |
Besoin d'un contrôle précis de l'évaporation dans vos processus de laboratoire ? Chez KINTEK, nous sommes spécialisés dans les équipements de laboratoire haute performance, y compris les étuves, les incubateurs et les enceintes climatiques qui fournissent les conditions exactes de température et de flux d'air dont vous avez besoin pour maîtriser l'évaporation pour la recherche, la préparation d'échantillons et la synthèse chimique. Laissez nos experts vous aider à choisir le bon équipement pour optimiser votre flux de travail. Contactez notre équipe dès aujourd'hui pour une consultation personnalisée !
Guide Visuel
Produits associés
- Lyophilisateur de laboratoire de paillasse pour usage en laboratoire
- Lyophilisateur de laboratoire de paillasse
- Autoclave de laboratoire Stérilisateur à levage par vide pulsé
- Stérilisateur de laboratoire Autoclave de laboratoire Stérilisateur à vapeur sous pression vertical pour écran à cristaux liquides de type automatique
- Tamis de laboratoire et machines de tamisage
Les gens demandent aussi
- Quels sont les types de lyophilisateurs de laboratoire disponibles et quelles sont leurs applications ? Choisissez le bon lyophilisateur pour votre laboratoire
- Pourquoi la phase de congélation est-elle considérée comme la plus critique dans la lyophilisation ? Elle établit le plan directeur du succès
- Quel rôle les lyophilisateurs de laboratoire jouent-ils dans l'industrie alimentaire ? Libérez une conservation alimentaire supérieure
- Quels éléments doivent être pris en compte lors du choix d'un lyophilisateur de laboratoire ? Faites correspondre vos échantillons et votre flux de travail pour réussir
- Quels sont les avantages d'utiliser un lyophilisateur de laboratoire ? Préserver l'intégrité des échantillons par lyophilisation



















