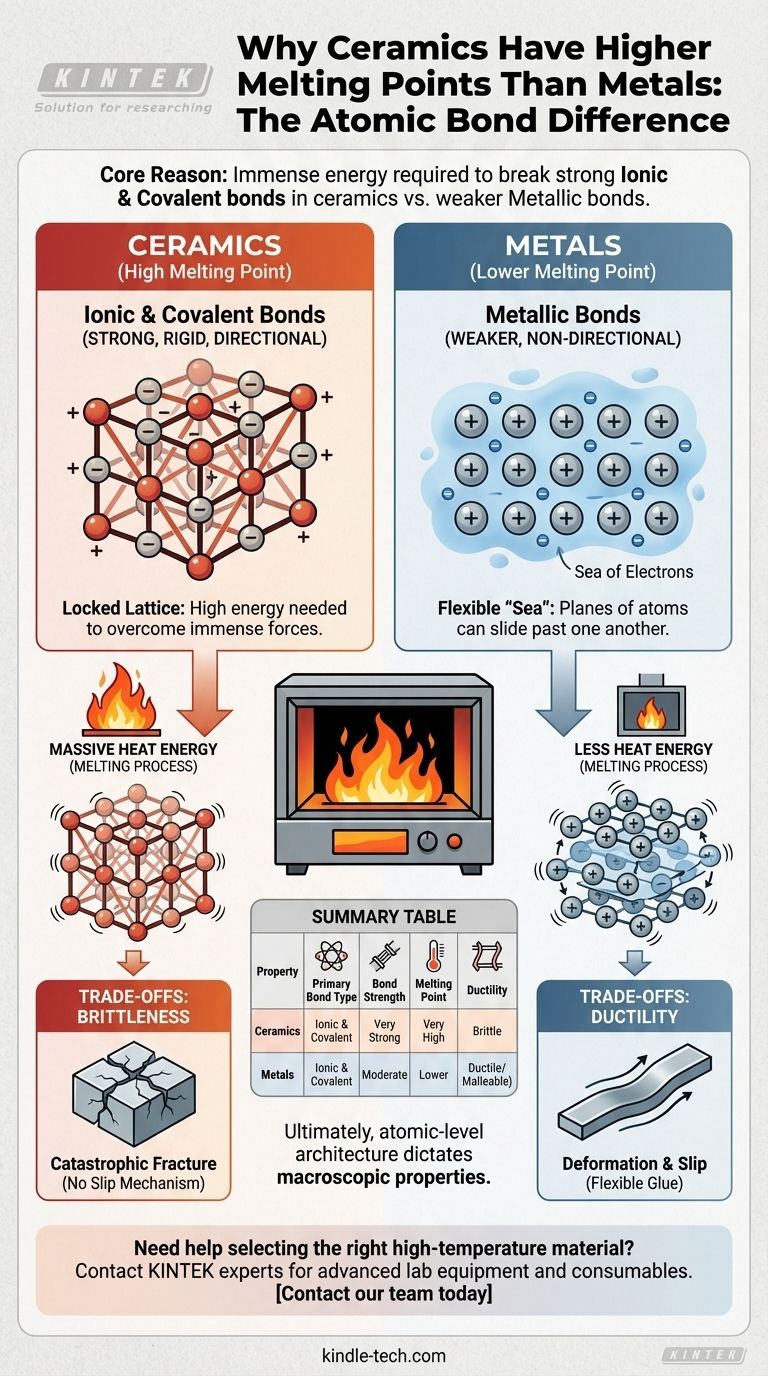
Au fond, l'énorme différence de température de fusion entre les céramiques et la plupart des métaux tient à la nature fondamentale de leurs liaisons atomiques. Les céramiques sont maintenues ensemble par des liaisons ioniques et covalentes extrêmement fortes, qui nécessitent une quantité massive d'énergie pour être rompues, tandis que les métaux sont maintenus ensemble par des liaisons métalliques faibles et non directionnelles.
Le principe déterminant est simple : le point de fusion d'un matériau est une mesure directe de l'énergie nécessaire pour rompre les liaisons qui maintiennent ses atomes ensemble. Les puissantes liaisons ioniques et covalentes dans les céramiques créent une structure rigide et stable qui exige beaucoup plus d'énergie thermique pour être démantelée que la « mer d'électrons » flexible qui définit les liaisons métalliques.

La différence déterminante : la liaison atomique
Pour comprendre les propriétés thermiques, nous devons d'abord comprendre comment les atomes se connectent les uns aux autres. Le type et la force de ces connexions sont les principaux facteurs qui dictent le point de fusion d'un matériau.
Les liaisons métalliques : une « mer » d'électrons
Dans les métaux, les électrons externes des atomes ne sont pas liés à un seul atome. Au lieu de cela, ils forment une « mer d'électrons » délocalisée qui circule librement autour d'un réseau fixe d'ions métalliques positifs.
Cet arrangement crée une force de cohésion forte, mais les liaisons sont non directionnelles. Cela permet aux plans d'atomes de glisser les uns sur les autres sans défaillance catastrophique, ce qui explique pourquoi les métaux sont ductiles et malléables.
Les liaisons ioniques : une attraction puissante
De nombreuses céramiques sont formées par des liaisons ioniques, qui se produisent entre des ions chargés positivement (cations) et des ions chargés négativement (anions). Un exemple classique est un oxyde métallique.
La puissante attraction électrostatique entre ces charges opposées crée des liaisons très fortes, rigides et directionnelles. Cela verrouille les ions dans un réseau cristallin hautement stable.
Les liaisons covalentes : la paire partagée
D'autres céramiques, comme le carbure de silicium, sont définies par des liaisons covalentes. Ici, les atomes partagent des électrons pour former des paires d'électrons stables, créant des liens exceptionnellement forts et hautement directionnels.
Ce type de liaison donne naissance à certains des matériaux les plus durs et les plus résistants à la chaleur connus, car la rupture de ces paires partagées nécessite une quantité énorme d'énergie.
Céramiques : un hybride de force
De manière cruciale, la plupart des céramiques avancées présentent un mélange de caractère ionique et covalent. Cette combinaison produit une structure atomique avec une énergie de liaison exceptionnellement élevée, créant un cadre rigide incroyablement résistant aux vibrations atomiques induites par la chaleur.
Comment la structure dicte la stabilité thermique
La liaison détermine la structure atomique, et cette structure détermine le comportement du matériau lorsqu'il est chauffé.
La fusion : le processus de rupture d'un réseau
La fusion est le processus consistant à fournir suffisamment d'énergie thermique pour permettre aux atomes ou aux ions de se libérer de leurs positions fixes dans le réseau cristallin. La chaleur est simplement une vibration atomique ; plus la température est élevée, plus les atomes vibrent violemment.
Pourquoi les liaisons plus fortes exigent plus d'énergie
Pour rompre le réseau rigide et directionnellement verrouillé d'une céramique, ses atomes doivent vibrer avec une intensité suffisante pour surmonter les forces ioniques et covalentes immenses qui les maintiennent en place. Cela nécessite une température très élevée.
En revanche, la nature délocalisée et non directionnelle des liaisons métalliques permet au réseau d'être perturbé avec beaucoup moins d'énergie thermique.
Comprendre les compromis
Cette stabilité thermique élevée des céramiques ne se fait pas sans compromis. La nature de la liaison qui confère la résistance introduit également des limitations importantes.
La force a un coût : la fragilité
Les mêmes liaisons fortes et directionnelles qui confèrent aux céramiques leur point de fusion élevé les rendent également fragiles. Lorsqu'une céramique est soumise à une contrainte, il n'y a pas de mécanisme facile pour que les atomes glissent les uns sur les autres.
Au lieu de cela, les liaisons rigides se fracturent de manière catastrophique. Toute petite fissure concentre la contrainte et se propage à travers le matériau avec très peu d'apport d'énergie.
L'avantage des métaux : la ductilité
La « mer d'électrons » dans les métaux agit comme une colle flexible. Elle permet aux plans atomiques de glisser et de se déformer sous contrainte sans rompre la cohésion globale du matériau.
Cette propriété, connue sous le nom de ductilité, est un compromis direct pour des liaisons plus faibles et, par conséquent, des points de fusion plus bas.
Faire le bon choix pour votre application
Comprendre ces différences fondamentales est essentiel pour la sélection des matériaux dans tout contexte d'ingénierie.
- Si votre objectif principal est l'intégrité structurelle à haute température : Les céramiques sont le choix sans équivoque en raison de l'exceptionnelle stabilité thermique conférée par leurs fortes liaisons ioniques et covalentes.
- Si votre objectif principal est la ténacité, la formabilité et la résistance à la rupture : Les métaux sont l'option supérieure, car leurs liaisons métalliques non directionnelles permettent la déformation plutôt qu'une défaillance catastrophique.
- Si vous avez besoin d'un équilibre de propriétés : Envisagez des matériaux avancés tels que les composites céramique-métal (cermets), qui sont conçus pour combiner la dureté des céramiques avec la ténacité des métaux.
En fin de compte, les propriétés macroscopiques d'un matériau sont le reflet direct de son architecture au niveau atomique.
Tableau récapitulatif :
| Propriété | Céramiques | Métaux |
|---|---|---|
| Type de liaison principal | Ionique et Covalente | Métallique |
| Force de la liaison | Très forte | Modérée |
| Point de fusion | Très élevé | Plus bas |
| Ductilité | Fragile | Ductile/Malléable |
Besoin d'aide pour choisir le bon matériau haute température pour votre application ? Chez KINTEK, nous sommes spécialisés dans la fourniture d'équipements de laboratoire et de consommables avancés pour les essais et la recherche sur les matériaux. Que vous travailliez avec des céramiques à point de fusion élevé ou des métaux ductiles, nos experts peuvent vous aider à choisir la solution parfaite pour les besoins de votre laboratoire. Contactez notre équipe dès aujourd'hui pour discuter de la manière dont nous pouvons soutenir votre recherche et garantir des performances optimales !
Guide Visuel
Produits associés
- Four à moufle de laboratoire à moufle à levage par le bas
- Four à moufle de 1800℃ pour laboratoire
- Four à moufle de four à étuve de 1400℃ pour laboratoire
- Four à moufle de 1700℃ pour laboratoire
- Four à tube de laboratoire à haute température de 1400℃ avec tube en alumine
Les gens demandent aussi
- Quelles sont les caractéristiques du SiC ? Débloquez les performances à haute température, dureté et inertie chimique
- Quel est le matériau le plus biocompatible pour les implants ? Un guide sur le titane, les céramiques et les polymères
- Quel est l'effet du frittage sur les céramiques ? Transformer la poudre en matériaux haute performance
- Les céramiques sont-elles chimiquement non réactives ? Découvrez leur remarquable résistance à la corrosion
- Lequel est le plus dur, le carbure de silicium ou le carbure de tungstène ? Découvrez la clé de la sélection des matériaux
- Quel est l'objectif de la cuisson ou du frittage ? Transformer une poudre faible en céramiques denses et solides
- Le carbure de silicium est-il utilisé dans les applications à haute température ? Maîtrisez la chaleur extrême avec le SiC
- Quelles métriques ont été utilisées pour évaluer le processus de rectification de la céramique composite (AlSiTi) ? Optimisez votre résultat de rectification



















