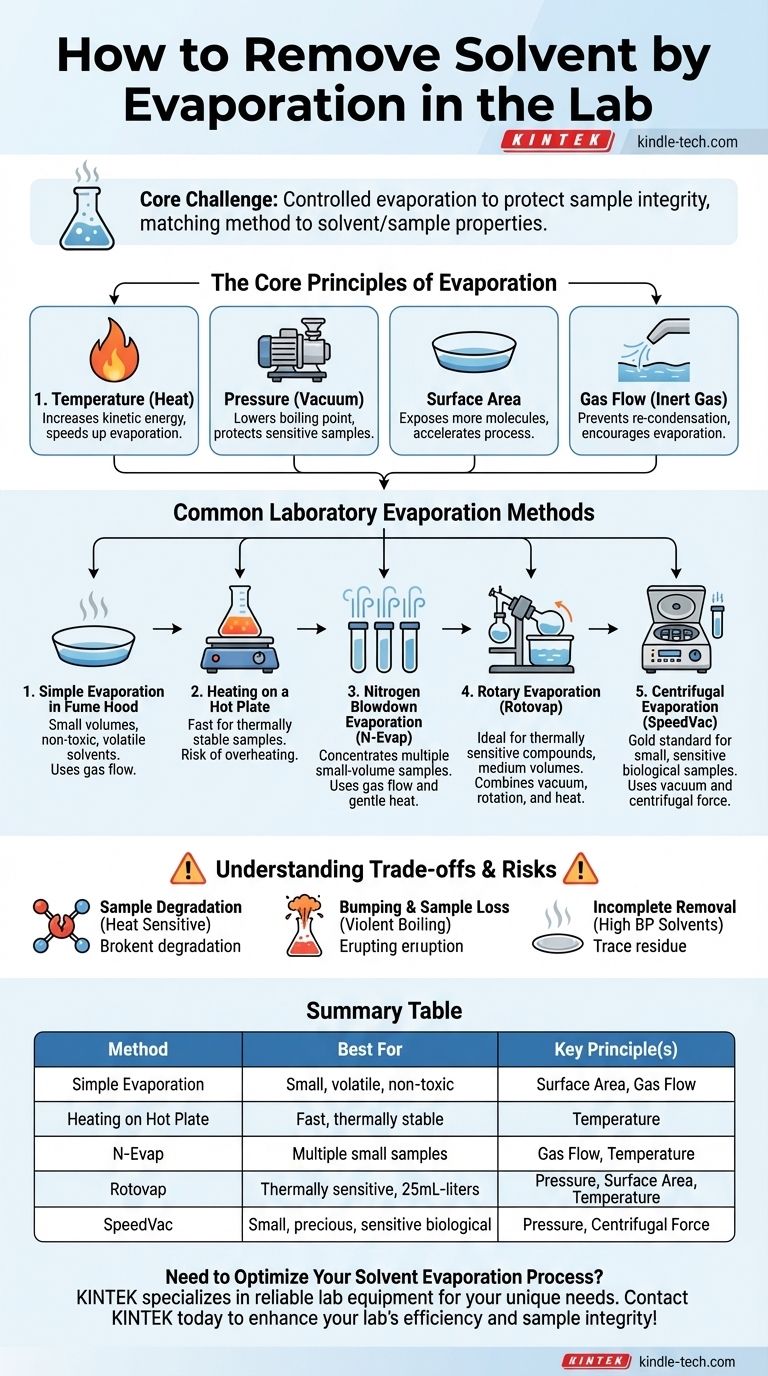
En laboratoire, l'élimination d'un solvant par évaporation implique l'application d'énergie, généralement sous forme de chaleur, et/ou la réduction de la pression ambiante. Cela donne aux molécules de solvant suffisamment d'énergie pour s'échapper en phase gazeuse, laissant derrière elles les composants moins volatils de votre mélange, tels que le produit désiré. Ce processus est activement géré à l'aide d'équipements spécifiques pour contrôler la vitesse et la température.
Le défi principal de l'élimination des solvants n'est pas seulement l'évaporation, mais l'évaporation contrôlée. Votre objectif est d'éliminer le solvant aussi rapidement que possible sans dégrader ou perdre l'échantillon que vous essayez d'isoler. La meilleure méthode dépend toujours des propriétés du solvant et de la sensibilité de l'échantillon.

Les principes fondamentaux de l'évaporation
Pour choisir la bonne méthode, vous devez d'abord comprendre les quatre facteurs que vous pouvez manipuler pour contrôler la vitesse d'évaporation. Ces principes sont la base de chaque technique.
Le rôle de la température
Augmenter la température d'un solvant augmente directement l'énergie cinétique de ses molécules. Cela leur permet de surmonter plus facilement les forces qui les retiennent en phase liquide et de s'échapper sous forme de gaz. Plus de chaleur signifie une évaporation plus rapide.
Le rôle de la pression
Réduire la pression au-dessus d'un liquide abaisse son point d'ébullition. C'est le principe le plus important pour manipuler des échantillons sensibles. En plaçant un échantillon sous vide, vous pouvez faire bouillir et évaporer le solvant à une température beaucoup plus basse et plus sûre, protégeant ainsi votre composé de la dégradation thermique.
Le rôle de la surface
L'évaporation ne se produit qu'à la surface du liquide. En augmentant la surface, vous exposez davantage de molécules de solvant à la phase gazeuse, ce qui accélère considérablement le processus. C'est pourquoi une flaque d'eau s'évapore plus vite que la même quantité d'eau dans une tasse profonde.
Le rôle du flux gazeux
Lorsqu'un solvant s'évapore, il crée une couche de vapeur juste au-dessus de la surface du liquide, ce qui peut entraîner une re-condensation. En soufflant un flux constant de gaz inerte (comme l'azote) sur la surface, vous repoussez constamment cette vapeur, encourageant davantage de liquide à s'évaporer pour rétablir l'équilibre.
Méthodes courantes d'évaporation en laboratoire
Ces principes sont appliqués à l'aide de plusieurs équipements de laboratoire standard, chacun adapté à différentes échelles et types d'échantillons.
Évaporation simple sous hotte
C'est la méthode la plus basique. L'échantillon est placé dans un récipient large et peu profond (comme une capsule d'évaporation ou un verre de montre) sous une hotte. Le flux d'air de la hotte fournit un léger flux gazeux pour emporter les vapeurs.
Cette méthode ne convient que pour de très petits volumes de solvants non toxiques et très volatils et pour des échantillons qui ne sont pas sensibles à l'air ou à une exposition prolongée.
Chauffage sur plaque chauffante
Un moyen simple d'accélérer l'évaporation est de chauffer doucement l'échantillon sur une plaque chauffante sous une hotte. Cela applique directement le principe d'augmentation de la température.
Bien que rapide, cette méthode offre un contrôle médiocre de la température et crée un risque élevé de surchauffe ou de "cognement" (ébullition violente), ce qui peut entraîner une perte et une dégradation de l'échantillon.
Évaporation par flux d'azote
Également connue sous le nom de N-Evap, cette technique utilise un manifold pour diriger plusieurs fins courants de gaz azote sur la surface des échantillons dans des flacons ou une microplaque. Elle inclut souvent un léger chauffage à partir d'un bloc ou d'un bain-marie en dessous.
Ceci est très efficace pour concentrer simultanément plusieurs échantillons de petit volume et est courant dans la préparation d'échantillons pour la chimie analytique.
Évaporation rotative ("Rotovap")
L'évaporateur rotatif est la pièce maîtresse du laboratoire de chimie de synthèse. Il combine tous les principes pour une élimination efficace et douce des solvants.
- Pression réduite : Une pompe à vide abaisse le point d'ébullition.
- Surface accrue : Le ballon est continuellement tourné, recouvrant les parois internes d'une fine pellicule de l'échantillon.
- Chauffage doux : Le ballon rotatif est placé dans un bain-marie pour un chauffage stable et contrôlé.
Cette méthode est idéale pour les composés thermosensibles et pour éliminer le solvant de volumes allant généralement de 25 mL à plusieurs litres.
Évaporation centrifuge ("SpeedVac")
Un évaporateur centrifuge (souvent appelé SpeedVac) place les échantillons sous un vide poussé tout en les faisant tourner dans une centrifugeuse. La force centrifuge empêche le cognement, et une chaleur douce est appliquée par rayonnement infrarouge.
C'est la référence pour concentrer en toute sécurité de nombreux petits échantillons précieux ou sensibles, tels que l'ADN, l'ARN ou les peptides, sans aucun risque de contamination croisée ou de perte.
Comprendre les compromis et les risques
Le choix d'une méthode nécessite d'équilibrer la vitesse et les problèmes potentiels. Être conscient de ces compromis est essentiel pour réussir.
Dégradation de l'échantillon
Le risque principal est la dégradation thermique. De nombreux composés organiques et presque toutes les molécules biologiques peuvent être détruits par une chaleur excessive. C'est pourquoi les méthodes utilisant une pression réduite, comme l'évaporation rotative, sont si essentielles.
Cognement et perte d'échantillon
Lorsqu'un liquide est chauffé sous vide sans agitation, il peut surchauffer puis bouillir violemment en une seule et grande éruption. Ce phénomène, appelé cognement, peut vous faire perdre une partie importante de votre échantillon dans le système de vide. La rotation (dans un rotovap) ou la force centrifuge (dans un SpeedVac) sont utilisées spécifiquement pour éviter cela.
Élimination incomplète du solvant
Les solvants à point d'ébullition élevé comme le DMSO ou le DMF peuvent être difficiles à éliminer complètement. Même sous un vide puissant, des traces peuvent subsister, contaminant votre produit final. Cela peut parfois être résolu en ajoutant un solvant plus volatil (comme le toluène) et en ré-évaporant, un processus connu sous le nom de séchage azéotropique.
Faire le bon choix pour votre échantillon
Votre décision doit être guidée par les caractéristiques de votre échantillon et votre objectif final.
- Si votre échantillon est thermiquement stable et le solvant volatil : Un simple chauffage sous hotte ou un flux d'azote peut être suffisant et rapide.
- Si votre échantillon est thermosensible ou d'un volume supérieur à 20 mL : Un évaporateur rotatif est le choix standard et le plus fiable.
- Si vous avez de nombreux petits échantillons biologiques très sensibles : Un évaporateur centrifuge offre le plus haut niveau de protection et d'efficacité.
- Si votre objectif est d'isoler un produit avec une pureté maximale : Choisissez toujours une méthode sous vide pour utiliser la température la plus basse possible, minimisant la formation de sous-produits thermiques.
En adaptant la technique aux besoins de votre échantillon, vous assurez une élimination efficace du solvant tout en maximisant l'intégrité et le rendement de votre produit final.
Tableau récapitulatif :
| Méthode | Idéal pour | Principe(s) clé(s) |
|---|---|---|
| Évaporation simple | Petits volumes de solvants non toxiques et volatils | Surface, Flux gazeux |
| Chauffage sur plaque chauffante | Évaporation rapide d'échantillons thermiquement stables | Température |
| Évaporation par flux d'azote (N-Evap) | Concentration de plusieurs échantillons de petit volume | Flux gazeux, Température |
| Évaporation rotative (Rotovap) | Composés thermosensibles ; volumes de 25mL à des litres | Pression, Surface, Température |
| Évaporation centrifuge (SpeedVac) | Petits échantillons biologiques précieux ou sensibles | Pression, Force centrifuge |
Besoin d'optimiser votre processus d'évaporation de solvant ?
Le choix du bon équipement est essentiel pour protéger vos échantillons sensibles et maximiser le rendement. KINTEK est spécialisé dans la fourniture d'équipements et de consommables de laboratoire fiables, adaptés aux besoins uniques de votre laboratoire.
Que vous ayez besoin d'un évaporateur rotatif doux pour vos flux de travail en chimie de synthèse ou d'un évaporateur centrifuge à haut débit pour des échantillons biologiques précieux, nous avons la solution.
Laissez nos experts vous aider à améliorer l'efficacité de votre laboratoire et l'intégrité de vos échantillons.
Contactez KINTEK dès aujourd'hui pour trouver le système d'évaporation parfait pour votre application !
Guide Visuel
Produits associés
- Lyophilisateur de laboratoire de paillasse pour usage en laboratoire
- Lyophilisateur de laboratoire de paillasse
- Autoclave de laboratoire Stérilisateur à levage par vide pulsé
- Stérilisateur de laboratoire Autoclave de laboratoire Stérilisateur à vapeur sous pression vertical pour écran à cristaux liquides de type automatique
- Tamis de laboratoire et machines de tamisage
Les gens demandent aussi
- Pourquoi la lyophilisation prolonge-t-elle la durée de conservation des produits ? Préserver la nutrition et la saveur pendant des années
- Quelles sont les principales applications pharmaceutiques des lyophilisateurs de laboratoire ? Stabiliser les médicaments de la R&D à la fabrication
- Quelle est la différence entre la lyophilisation et la lyophilisation ? Le même processus de conservation puissant dévoilé
- Qu'est-ce que la lyophilisation et comment fonctionne-t-elle ? Un guide complet sur la lyophilisation
- Quelles sont les trois phases de la lyophilisation ? Maîtriser la lyophilisation pour une conservation parfaite



















