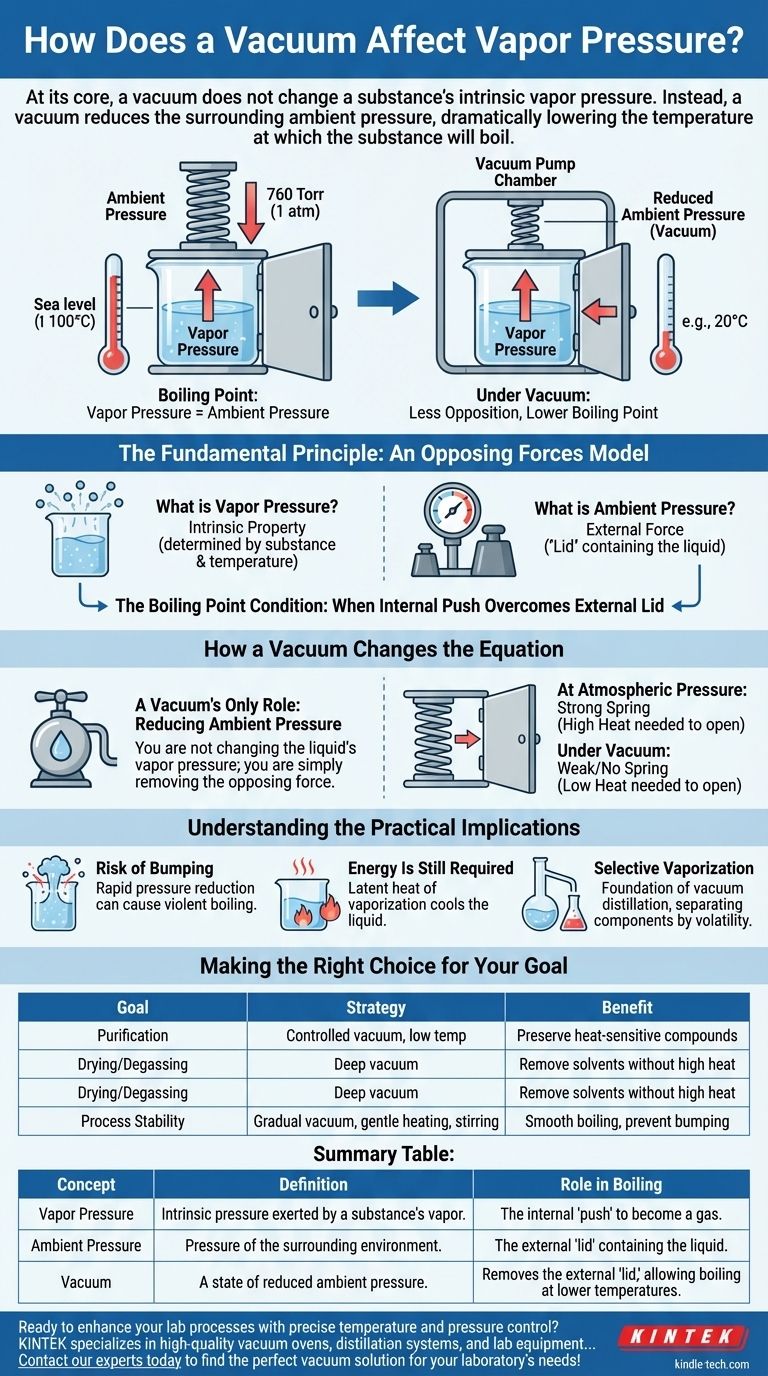
Fondamentalement, le vide ne modifie pas la pression de vapeur intrinsèque d'une substance. Au lieu de cela, le vide réduit la pression ambiante environnante, ce qui abaisse considérablement la température à laquelle la substance va bouillir. La pression de vapeur d'une substance est une propriété fondamentale déterminée uniquement par la substance elle-même et sa température.
L'ébullition se produit lorsque la pression de vapeur interne d'un liquide égale ou dépasse la pression externe qui s'exerce sur lui. Le vide supprime simplement cette pression externe, ce qui facilite grandement la "victoire" de la pression de vapeur du liquide et le déclenchement de l'ébullition, même à des températures beaucoup plus basses.
Le principe fondamental : un modèle de forces opposées
Pour comprendre le rôle du vide, vous devez d'abord distinguer deux concepts clés : la "poussée" interne du liquide et la "poussée" externe de l'environnement.
Qu'est-ce que la pression de vapeur ?
La pression de vapeur est la pression exercée par la vapeur d'une substance lorsqu'elle est en équilibre avec sa phase liquide ou solide. Considérez-la comme la tendance inhérente de la substance à s'échapper et à devenir un gaz.
Cette propriété est intrinsèque au matériau et dépend principalement de la température. Lorsque vous ajoutez de la chaleur, les molécules se déplacent plus rapidement, et un plus grand nombre d'entre elles ont suffisamment d'énergie pour s'échapper de la surface du liquide, augmentant ainsi la pression de vapeur.
Qu'est-ce que la pression ambiante ?
La pression ambiante est la pression de l'environnement environnant qui s'exerce sur la surface de la substance. Au niveau de la mer, il s'agit du poids de l'atmosphère au-dessus de nous (environ 760 Torr ou 1 atm).
Cette force externe agit comme un "couvercle", contenant le liquide et rendant plus difficile l'échappement des molécules.
La condition du point d'ébullition
Un liquide bout lorsque sa poussée interne surmonte le couvercle externe. La définition technique du point d'ébullition est la température à laquelle la pression de vapeur est égale à la pression ambiante. C'est la relation critique à comprendre.
Comment le vide modifie l'équation
Un système de vide n'interagit pas avec les molécules du liquide pour modifier leurs propriétés inhérentes. Son seul rôle est de modifier l'environnement externe.
Le seul rôle du vide : réduire la pression ambiante
Une pompe à vide fonctionne en retirant les molécules de gaz (comme l'air) d'une chambre scellée. En retirant ces molécules, elle abaisse considérablement la pression ambiante qui s'exerce sur le liquide à l'intérieur.
Vous ne modifiez pas la pression de vapeur du liquide ; vous supprimez simplement la force opposée.
Atteindre le point d'ébullition plus tôt
Imaginez que vous essayez d'ouvrir une porte à ressort. La pression de vapeur est la force que vous appliquez à la porte, et la pression ambiante est la force du ressort qui repousse.
- À pression atmosphérique : Le ressort est fort. Vous devez pousser très fort (ajouter beaucoup de chaleur) pour ouvrir la porte (faire bouillir le liquide).
- Sous vide : Vous avez retiré le ressort. Maintenant, même une légère poussée (une petite quantité de chaleur) suffit à ouvrir la porte facilement.
La nature de la porte n'a pas changé, seule l'opposition. C'est pourquoi l'eau, qui bout à 100°C (212°F) au niveau de la mer, peut bouillir à température ambiante sous un vide suffisant.
Comprendre les implications pratiques
L'application d'un vide est une technique puissante, mais elle s'accompagne de comportements et de limitations spécifiques que vous devez gérer.
Risque de "chocs"
Si la pression est réduite trop rapidement, le liquide peut devenir surchauffé. L'énergie s'accumule sans ébullition jusqu'à ce qu'elle éclate en un seul événement violent connu sous le nom de "choc" (bumping). C'est pourquoi une application progressive et contrôlée du vide et une agitation sont essentielles dans les laboratoires et les milieux industriels.
De l'énergie est toujours nécessaire
Même sous un vide parfait, l'ébullition n'est pas instantanée ou "gratuite". Le changement de phase du liquide au gaz (évaporation) nécessite toujours de l'énergie, connue sous le nom de chaleur latente de vaporisation. S'il n'y a pas de source de chaleur externe, le liquide puisera cette énergie en lui-même, ce qui entraînera une chute rapide de sa température. C'est le principe de la lyophilisation.
Vaporisation sélective
Ce principe est le fondement de la distillation sous vide. Deux liquides ayant des points d'ébullition différents peuvent être séparés à basse température, ce qui les empêche de se dégrader. La substance la plus volatile (avec la pression de vapeur intrinsèque la plus élevée) s'évaporera en premier sous vide, laissant la substance moins volatile derrière.
Faire le bon choix pour votre objectif
Comprendre cette relation vous permet de contrôler les processus avec précision. Votre stratégie dépendra de ce que vous essayez d'accomplir.
- Si votre objectif principal est la purification : Utilisez un vide contrôlé pour séparer les composants volatils d'un mélange à basse température, en préservant les composés sensibles à la chaleur.
- Si votre objectif principal est le séchage ou le dégazage : Appliquez un vide poussé pour éliminer les solvants résiduels comme l'eau ou l'air d'un échantillon sans avoir à le chauffer à haute température.
- Si votre objectif principal est la stabilité du processus : Combinez un vide progressif avec un chauffage doux et une agitation pour obtenir une ébullition régulière et éviter les chocs violents.
En maîtrisant l'interaction entre la température et la pression, vous obtenez un contrôle précis sur l'état physique de vos matériaux.

Tableau récapitulatif :
| Concept | Définition | Rôle dans l'ébullition |
|---|---|---|
| Pression de vapeur | Pression intrinsèque exercée par la vapeur d'une substance. | La « poussée » interne du liquide pour devenir un gaz. |
| Pression ambiante | Pression de l'environnement (par exemple, l'atmosphère). | Le « couvercle » externe contenant le liquide. |
| Vide | Un état de pression ambiante réduite. | Supprime le « couvercle » externe, permettant l'ébullition à des températures plus basses. |
Prêt à améliorer vos processus de laboratoire avec un contrôle précis de la température et de la pression ?
KINTEK est spécialisé dans les fours sous vide, les systèmes de distillation et les équipements de laboratoire de haute qualité conçus pour une ébullition, un séchage et une purification efficaces à basse température. Nos solutions vous aident à préserver les matériaux sensibles à la chaleur et à améliorer la stabilité des processus.
Contactez nos experts dès aujourd'hui pour trouver la solution de vide parfaite pour les besoins de votre laboratoire !
Guide Visuel
Produits associés
- Refroidisseur de piège froid direct pour piège froid sous vide
- Refroidisseur à piège froid sous vide Refroidisseur à piège froid indirect
- Pompe à vide à circulation d'eau verticale de laboratoire pour usage en laboratoire
- Plaque borgne à bride sous vide en acier inoxydable KF ISO pour systèmes de vide poussé
- Four de frittage et de brasage sous vide pour traitement thermique
Les gens demandent aussi
- Quels sont les avantages techniques de l'utilisation d'une étuve sous vide pour la préparation du catalyseur BixIn2-xO3 ? Augmentation de l'activité de surface
- Peut-on braser de l'aluminium épais ? Oui, avec la bonne gestion de la chaleur et de l'atmosphère pour des joints solides.
- Quelles sont les utilisations du four à vide ? Obtenez une pureté et des performances matérielles inégalées
- Comment réaliser le moulage sous vide ? Un guide étape par étape pour des prototypes et des pièces en petite série impeccables
- Quelles caractéristiques un four à vide doit-il posséder pour les revêtements de phase MAX Cr2AlC ? Contrôles de précision pour la synthèse de haute pureté
- Pourquoi un four de séchage sous vide est-il nécessaire pour les électrolytes polymères solides (SPE) à base de PEO ? Assurer la stabilité anhydre dans la préparation de batteries à état solide
- Quelle température est nécessaire pour la coulée de métal ? Obtenez des moulages parfaits avec la bonne surchauffe
- Pouvez-vous déterminer la température d'un vide ? Décryptage de la physique de l'espace « vide »



















