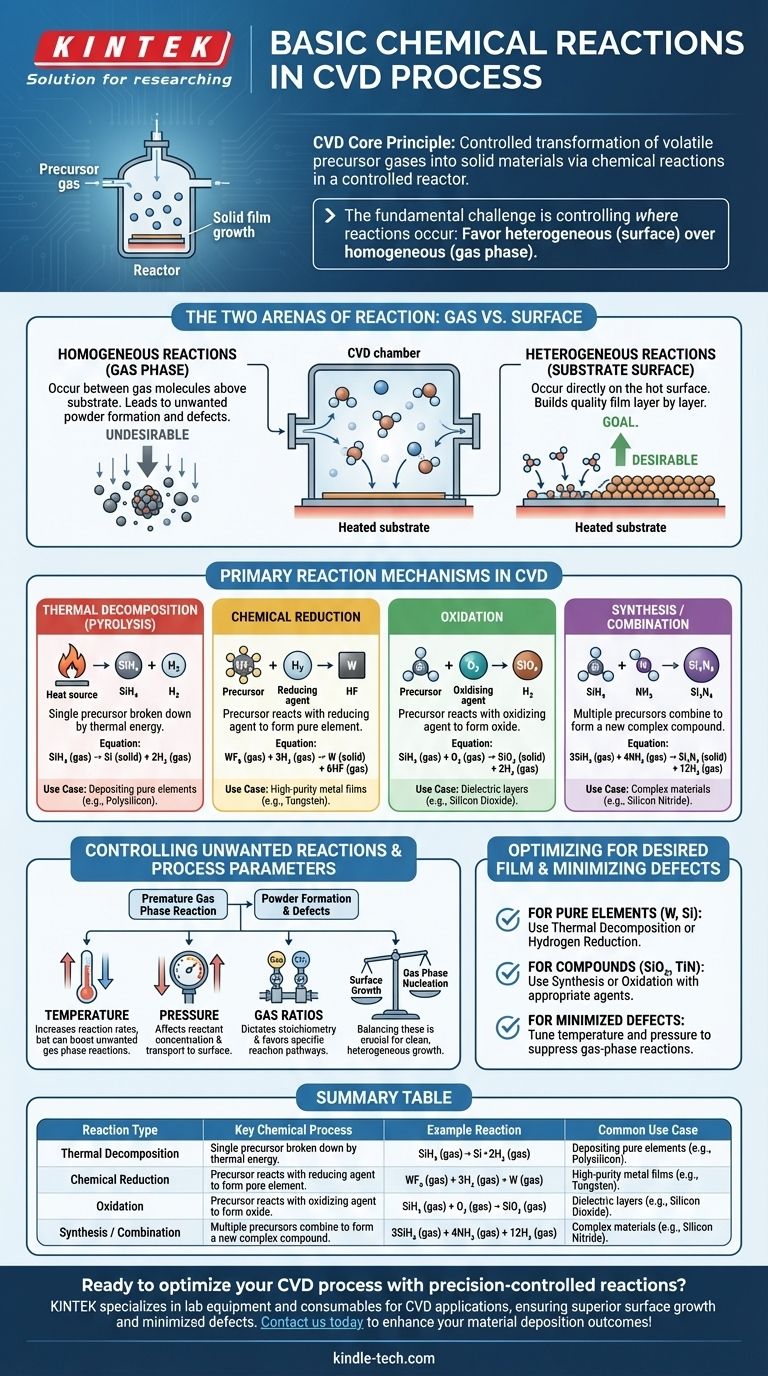
À la base, le dépôt chimique en phase vapeur (CVD) est un processus de réactions chimiques contrôlées. Ces réactions sont conçues pour transformer des gaz précurseurs stables et volatils en un matériau solide et non volatil directement sur un substrat. Les mécanismes les plus courants qui entraînent cette transformation sont la décomposition thermique (pyrolyse), la réduction chimique, l'oxydation et les réactions de synthèse, qui se déroulent toutes dans un environnement de réacteur hautement contrôlé.
Le défi fondamental dans tout processus CVD n'est pas seulement d'initier des réactions chimiques, mais de contrôler précisément où elles se produisent. L'objectif est de favoriser les réactions hétérogènes à la surface du substrat pour construire une couche de qualité, tout en minimisant les réactions homogènes en phase gazeuse qui créent des particules indésirables.

Les deux arènes de la réaction : gaz contre surface
Chaque réaction chimique dans une chambre CVD se produit dans l'un des deux endroits suivants. L'équilibre entre eux détermine la qualité et la structure du matériau final.
Réactions Homogènes (En Phase Gazeuse)
Ces réactions se produisent entre les molécules de gaz elles-mêmes, en suspension dans l'espace au-dessus du substrat.
Bien qu'une certaine chimie en phase gazeuse soit nécessaire pour créer des espèces intermédiaires réactives, des réactions homogènes excessives sont souvent indésirables. Elles peuvent entraîner la formation de particules solides ou de « poudres » qui retombent ensuite sur le substrat, provoquant des défauts et compromettant la qualité de la couche.
Réactions Hétérogènes (Sur la Surface du Substrat)
Ce sont les réactions qui construisent la couche. Elles se produisent directement sur, ou dans une très fine couche adjacente à, la surface chauffée du substrat.
L'objectif d'un processus CVD bien conçu est de maximiser le taux des réactions hétérogènes. Les gaz précurseurs s'adsorbent sur la surface chaude, se décomposent ou réagissent avec d'autres espèces adsorbées, et forment la couche solide stable couche par couche atomique.
Principaux mécanismes de réaction en CVD
Bien qu'elles se produisent dans l'une des deux « arènes » ci-dessus, les réactions elles-mêmes peuvent être classées en plusieurs types clés en fonction de la transformation chimique impliquée.
Décomposition Thermique (Pyrolyse)
C'est le type de réaction CVD le plus simple et le plus courant. Un seul gaz précurseur est décomposé en ses parties constitutives par la seule énergie thermique.
La chaleur du substrat fournit l'énergie nécessaire pour rompre les liaisons chimiques de la molécule précurseur, laissant l'élément solide souhaité se déposer sur la surface. Un exemple classique est le dépôt de polysilicium à partir de gaz silane.
SiH₄ (gaz) → Si (solide) + 2H₂ (gaz)
Réduction Chimique
Dans ce processus, un gaz précurseur (souvent un halogénure métallique) réagit avec un agent réducteur, typiquement l'hydrogène (H₂), pour former une couche élémentaire pure.
C'est une méthode courante pour déposer des couches métalliques de haute pureté comme le tungstène. L'hydrogène arrache les atomes d'halogène du précurseur métallique, permettant au métal pur de se déposer.
WF₆ (gaz) + 3H₂ (gaz) → W (solide) + 6HF (gaz)
Oxydation
Cette réaction implique la réaction d'un gaz précurseur avec un agent oxydant, tel que l'oxygène (O₂), le protoxyde d'azote (N₂O) ou la vapeur d'eau (H₂O), pour former une couche d'oxyde solide.
C'est le processus fondamental pour créer des couches diélectriques isolantes comme le dioxyde de silicium (SiO₂), un composant essentiel dans presque toute la microélectronique moderne.
SiH₄ (gaz) + O₂ (gaz) → SiO₂ (solide) + 2H₂ (gaz)
Synthèse ou Combinaison
Ici, deux gaz précurseurs ou plus sont introduits pour se combiner et former un nouveau matériau composé sur le substrat. Cela permet la création de matériaux complexes qui ne peuvent pas être formés par une simple décomposition.
Par exemple, le nitrure de silicium (Si₃N₄), un matériau dur et chimiquement résistant, est formé en faisant réagir une source de silicium avec une source d'azote, comme l'ammoniac.
3SiH₄ (gaz) + 4NH₃ (gaz) → Si₃N₄ (solide) + 12H₂ (gaz)
Comprendre les compromis : contrôler les réactions indésirables
Le succès d'un processus CVD dépend entièrement du contrôle de l'environnement réactionnel pour favoriser les voies chimiques souhaitées.
Le problème de la formation de poudre
Le principal écueil en CVD est la nucléation non intentionnelle en phase gazeuse. Si la température du réacteur est trop élevée ou la pression trop forte, les gaz précurseurs peuvent réagir prématurément en phase gazeuse (réaction homogène) avant d'atteindre le substrat. Cela crée des particules qui peuvent provoquer des défauts ou former une couche poudreuse de faible densité au lieu d'une couche dense de haute qualité.
Le rôle des paramètres de processus
Les ingénieurs utilisent plusieurs paramètres clés comme leviers pour contrôler la cinétique et la localisation des réactions :
- Température : Augmente les vitesses de réaction mais peut également augmenter les réactions en phase gazeuse indésirables.
- Pression : Affecte la concentration des réactifs et la rapidité avec laquelle ils se déplacent vers la surface.
- Ratios de gaz : Détermine la stœchiométrie et contrôle la voie de réaction favorisée.
L'équilibre entre ces facteurs est crucial pour favoriser une croissance hétérogène propre sur la surface du substrat.
Optimiser les réactions pour la couche souhaitée
La voie de réaction chimique spécifique que vous utilisez est entièrement déterminée par le matériau que vous avez l'intention de créer.
- Si votre objectif principal est de déposer un élément pur (par exemple, tungstène, silicium) : Vous vous appuierez probablement sur la décomposition thermique ou une réaction de réduction par l'hydrogène utilisant un seul précurseur et éventuellement un agent réducteur.
- Si votre objectif principal est de créer un oxyde ou un nitrure composé (par exemple, SiO₂, TiN) : Vous utiliserez une réaction de synthèse ou d'oxydation, en introduisant un agent oxydant ou nitrurant à côté de votre précurseur principal.
- Si votre objectif principal est de minimiser les défauts et d'obtenir une couche de haute qualité : Votre tâche principale consiste à ajuster la température et la pression pour supprimer les réactions homogènes en phase gazeuse et promouvoir une croissance hétérogène propre sur le substrat.
En fin de compte, maîtriser le CVD, c'est maîtriser l'art de diriger la chimie pour qu'elle se produise à un moment et à un endroit spécifiques.
Tableau récapitulatif :
| Type de réaction | Processus chimique clé | Réaction exemple | Cas d'utilisation courant |
|---|---|---|---|
| Décomposition Thermique (Pyrolyse) | Un seul précurseur se décompose par la chaleur | SiH₄ (gaz) → Si (solide) + 2H₂ (gaz) | Dépôt d'éléments purs comme le polysilicium |
| Réduction Chimique | Le précurseur réagit avec un agent réducteur (ex. H₂) | WF₆ (gaz) + 3H₂ (gaz) → W (solide) + 6HF (gaz) | Couches métalliques de haute pureté (ex. tungstène) |
| Oxydation | Le précurseur réagit avec un agent oxydant (ex. O₂) | SiH₄ (gaz) + O₂ (gaz) → SiO₂ (solide) + 2H₂ (gaz) | Couches diélectriques comme le dioxyde de silicium |
| Synthèse/Combinaison | Plusieurs précurseurs se combinent pour former un composé | 3SiH₄ (gaz) + 4NH₃ (gaz) → Si₃N₄ (solide) + 12H₂ (gaz) | Matériaux complexes comme le nitrure de silicium |
Prêt à optimiser votre processus CVD avec des réactions contrôlées avec précision ? KINTEK est spécialisé dans les équipements de laboratoire et les consommables pour les applications CVD, vous aidant à obtenir des couches minces sans défaut grâce à des solutions de réacteurs sur mesure. Que vous déposiez des métaux, des oxydes ou des nitrures, notre expertise garantit une croissance de surface supérieure et minimise les défauts en phase gazeuse. Contactez-nous dès aujourd'hui pour discuter de la manière dont nos systèmes CVD peuvent améliorer vos résultats de dépôt de matériaux !
Guide Visuel
Produits associés
- Équipement de dépôt chimique en phase vapeur assisté par plasma incliné pour le dépôt chimique en phase vapeur assisté par plasma (PECVD) pour fours tubulaires
- Système d'équipement de machine HFCVD pour le revêtement de nanodiamant de filière de tréfilage
- Système de réacteur de dépôt chimique en phase vapeur assisté par plasma micro-ondes (MPCVD) pour diamant 915 MHz
- Four à presse à chaud sous vide pour stratification et chauffage
- Matériaux diamantés dopés au bore par CVD
Les gens demandent aussi
- Quelles sont les capacités de processus des systèmes ICPCVD ? Obtenir un dépôt de film à faible endommagement à des températures ultra-basses
- Quels sont les différents types de couches minces ? Un guide sur la fonction, les matériaux et les méthodes de dépôt
- Comment les films minces sont-ils déposés ? Un guide des méthodes PVD vs CVD pour votre application
- Quel est le processus de la CVD assistée par plasma (PECVD) dans les semi-conducteurs ? Permettre le dépôt de couches minces à basse température
- Pourquoi un système de vide PECVD nécessite-t-il à la fois une pompe à palettes rotatives et une pompe turbo ? Assurer des revêtements de haute pureté



















