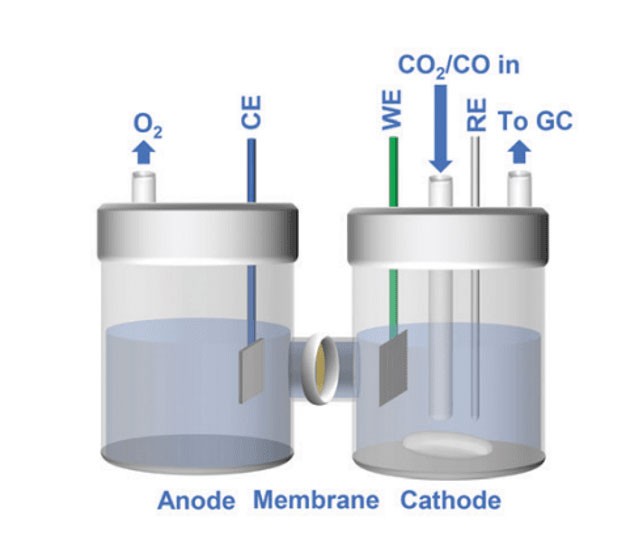
Introduction aux cellules électrolytiques à quartz
Les cellules électrolytiques à quartz sont essentielles pour transformer l'énergie électrique en énergie chimique, jouant ainsi un rôle crucial dans divers processus industriels. Ces cellules se caractérisent par l'utilisation du quartz comme matériau clé, qui non seulement résiste aux températures élevées, mais conserve également son inertie chimique. Les cellules électrolytiques à quartz sont constituées d'électrodes et d'électrolytes qui, ensemble, facilitent des réactions précises d'oxydation et de réduction. Cette introduction ouvre la voie à une exploration plus approfondie des mécanismes, des applications et des avantages des cellules électrolytiques à quartz, en soulignant leur importance dans des industries allant de la production de métaux aux produits pharmaceutiques.
Mécanisme d'action des cellules électrolytiques à quartz
Les cellules électrolytiques à quartz sont des dispositifs spécialisés utilisés dans divers processus industriels, en particulier dans l'électro-affinage et l'extraction électrolytique de métaux non ferreux tels que l'aluminium, le cuivre, le zinc et le plomb. Ces cellules sont conçues pour faciliter la migration des ions et la conduction efficace des réactions d'oxydation et de réduction grâce à l'utilisation d'une structure en quartz et d'un milieu électrolytique soigneusement choisi.
Migration des ions et rôle des électrodes
Dans une cellule électrolytique en quartz, le processus commence lorsqu'une tension externe est appliquée au système. Cette tension entraîne la migration des ions dans l'électrolyte. Les ions positifs, ou cations, sont attirés par la cathode chargée négativement, tandis que les ions négatifs, ou anions, se déplacent vers l'anode chargée positivement. Ce mouvement des ions est crucial pour la conduction de l'électricité et le déclenchement des réactions chimiques.
À la cathode, des réactions de réduction se produisent. Les cations gagnent des électrons et se déposent sur la surface de la cathode. Par exemple, dans l'électroaffinage du cuivre, les ions cuivre (Cu²⁺) gagnent des électrons pour former du cuivre métal pur, qui est ensuite déposé sur la cathode. Ce processus est essentiel pour obtenir des métaux de haute pureté utilisés dans diverses applications industrielles.
À l'inverse, à l'anode, des réactions d'oxydation ont lieu. Les anions perdent des électrons et libèrent d'autres ions ou molécules. Dans le cas de l'électroaffinage du cuivre, l'anode est constituée de cuivre impur. En se dissolvant, le cuivre libère des impuretés dans l'électrolyte, qui sont ensuite éliminées, laissant du cuivre pur à la cathode.

Importance du milieu électrolytique
Le milieu électrolytique dans une cellule d'électrolyse à quartz joue un rôle essentiel dans l'efficacité des réactions. L'électrolyte doit être un bon conducteur d'ions et doit être stable dans les conditions de la réaction. Les électrolytes courants comprennent les solutions aqueuses de sels, d'acides ou de bases, ainsi que les sels fondus.
Le choix de l'électrolyte dépend des exigences spécifiques de la réaction, telles que le pH souhaité, la concentration d'ions et la température à laquelle la réaction se produit. Par exemple, dans la production d'aluminium de haute pureté, un mélange fondu de cryolithe (Na₃AlF₆) et d'alumine (Al₂O₃) est utilisé comme électrolyte. Ce mélange a un point de fusion bas et est très conducteur, ce qui le rend idéal pour la réduction électrolytique de l'alumine en aluminium.
La structure du quartz et ses avantages
L'utilisation du quartz dans les cellules électrolytiques présente plusieurs avantages. Le quartz est un excellent isolant, ce qui permet de maintenir l'intégrité du champ électrique à l'intérieur de la cellule. En outre, le quartz est résistant à la corrosion chimique, ce qui permet à la cellule de fonctionner dans des conditions difficiles sans se dégrader.
La structure du quartz permet également un contrôle précis de la distribution des ions et du flux d'électricité. Cette précision est essentielle pour optimiser l'efficacité des réactions et minimiser les pertes d'énergie. En outre, la transparence du quartz permet de surveiller visuellement les réactions, ce qui est utile pour le contrôle des processus et le dépannage.
Applications dans le domaine de la purification des métaux et de la galvanoplastie
Les cellules électrolytiques en quartz sont largement utilisées dans la purification des métaux et dans les processus de galvanoplastie. Dans la purification des métaux, comme l'électroaffinage du cuivre, le métal impur est utilisé comme anode et un métal pur est déposé sur la cathode. Ce processus permet d'éliminer les impuretés et d'obtenir un métal de grande pureté adapté à diverses applications industrielles.
En galvanoplastie, des cellules électrolytiques à quartz sont utilisées pour déposer une fine couche du métal souhaité sur un substrat. Ce processus améliore les propriétés du substrat, telles que son apparence, sa durabilité et sa résistance à la corrosion. La galvanoplastie est couramment utilisée dans les secteurs de l'automobile, de l'aérospatiale et de l'électronique.
Conclusion
En résumé, les cellules électrolytiques à quartz sont des outils essentiels dans la production de métaux de haute pureté et dans divers processus électrochimiques. Leur mécanisme d'action implique la migration des ions, le rôle des électrodes dans la facilitation des réactions d'oxydation et de réduction, et l'importance du milieu électrolytique. L'utilisation du quartz présente plusieurs avantages, notamment l'isolation, la résistance à la corrosion et le contrôle précis des réactions. Ces cellules sont largement utilisées pour la purification des métaux et la galvanoplastie, contribuant ainsi à l'avancement de diverses applications industrielles.
Applications des cellules électrolytiques à quartz
Les cellules d'électrolyse à quartz jouent un rôle crucial dans diverses applications industrielles, notamment dans la production de métaux de haute pureté, l'électrolyse de l'eau et l'industrie pharmaceutique. Ces cellules sont conçues pour résister à des températures élevées et à des environnements corrosifs, ce qui les rend idéales pour les processus qui exigent précision et fiabilité.
Production de métaux de haute pureté
L'une des principales applications des cellules électrolytiques à quartz est la production de métaux de haute pureté tels que l'aluminium et le cuivre. Le processus électrolytique implique l'utilisation d'un courant continu pour entraîner une réaction chimique non spontanée. Dans le cas de la production d'aluminium, la matière première, la bauxite, est dissoute dans un bain de cryolithe en fusion. Les ions d'aluminium sont ensuite réduits à la cathode, ce qui entraîne le dépôt d'aluminium pur. Ce processus est très énergivore mais garantit un niveau de pureté allant jusqu'à 99,99 %.
De même, le cuivre de haute pureté est produit par un processus connu sous le nom d'électro-affinage. Dans ce processus, le cuivre impur est utilisé comme anode, et lorsque le courant passe à travers la cellule électrolytique, des ions de cuivre pur sont déposés sur la cathode. Les impuretés restent dans l'électrolyte ou forment une boue séparée au fond de la cellule, ce qui garantit la pureté du produit final.
Électrolyse de l'eau
Les cellules électrolytiques en quartz sont également largement utilisées dans l'électrolyse de l'eau, un processus qui sépare l'eau en ses éléments constitutifs, l'hydrogène et l'oxygène. Ce procédé est particulièrement utile dans les industries qui ont besoin de grandes quantités de ces gaz, comme les industries chimiques et pharmaceutiques. L'électrolyse de l'eau consiste à faire passer un courant électrique dans de l'eau contenant des ions dissous (provenant généralement d'un sel ou d'un acide). Les ions hydrogène (H+) migrent vers la cathode, où ils sont réduits en hydrogène gazeux, tandis que les ions hydroxyde (OH-) migrent vers l'anode, où ils sont oxydés en oxygène gazeux.

Industrie pharmaceutique
Dans l'industrie pharmaceutique, les cellules électrolytiques à quartz sont utilisées pour la production de divers produits chimiques et composés. Par exemple, l'électrolyse d'une solution de chlorure de sodium (saumure) est utilisée pour produire du chlore gazeux et de l'hydroxyde de sodium (soude caustique), deux matières premières essentielles dans la synthèse de nombreux produits pharmaceutiques. Le contrôle précis du processus électrolytique assuré par les cellules de quartz garantit la pureté et la constance de ces produits chimiques, qui sont essentiels pour les applications pharmaceutiques.
Placage électrolytique et traitement de surface
Une autre application importante des cellules électrolytiques en quartz est la galvanoplastie et les processus de traitement de surface. La galvanoplastie consiste à déposer une fine couche d'un métal spécifique sur la surface d'un autre métal afin d'en améliorer les propriétés, telles que la résistance à la corrosion, la résistance à l'usure ou l'attrait esthétique. Les cellules de quartz offrent un environnement stable et contrôlé pour ces procédés, garantissant des revêtements uniformes et de haute qualité.
Consommation d'énergie et efficacité
La consommation d'énergie des procédés électrolytiques varie en fonction du métal produit. Par exemple, la production électrolytique d'aluminium nécessite environ 13 à 15 kWh d'électricité par kilogramme de métal. En revanche, le raffinage du cuivre par électrolyse consomme entre 150 et 300 kWh par tonne de cuivre raffiné. Malgré les besoins énergétiques élevés, l'efficacité et la pureté des produits finaux rendent ces procédés indispensables dans l'industrie moderne.
En conclusion, les cellules électrolytiques à quartz sont essentielles dans divers secteurs industriels, offrant un contrôle précis et une grande efficacité dans la production de métaux de haute pureté, l'électrolyse de l'eau et les produits chimiques pharmaceutiques. Leur capacité à fonctionner dans des environnements difficiles et leur durabilité en font un outil essentiel dans les industries modernes de fabrication et de transformation.
Avantages de l'utilisation du quartz dans les cellules électrolytiques
Le quartz, une forme de silice (SiO2), est réputé pour ses propriétés uniques qui en font un matériau idéal pour les cellules électrolytiques. Ces cellules jouent un rôle essentiel dans divers processus industriels, notamment la production de produits chimiques, de métaux et de semi-conducteurs. Le choix du quartz par rapport à d'autres matériaux comme le verre est principalement dû à sa résistance supérieure aux températures élevées, à son inertie chimique et à ses excellentes propriétés électriques.
Résistance aux températures élevées
Le quartz peut résister à des températures allant jusqu'à 1100°C, ce qui est nettement plus élevé que le verre, qui se ramollit à environ 700°C. Cette résistance aux températures élevées est vitale dans les cellules électrolytiques où les températures peuvent augmenter considérablement en raison des courants électriques et des réactions chimiques en jeu. La capacité du quartz à maintenir son intégrité structurelle dans de telles conditions garantit la longévité et l'efficacité du processus électrolytique.
Inertie chimique
Le quartz est très résistant à la plupart des produits chimiques, y compris les acides, les alcalis et les sels. Cette inertie chimique est particulièrement utile dans les cellules électrolytiques, où l'environnement est souvent très corrosif en raison des électrolytes utilisés. L'utilisation du quartz permet de minimiser le risque de réactions chimiques susceptibles de dégrader les composants de la cellule, ce qui améliore la durabilité et les performances de la cellule.

Propriétés électriques
Contrairement au verre, qui est un bon isolant, le quartz est un excellent conducteur d'électricité. Cette propriété est cruciale dans les cellules électrolytiques où la conduction efficace de l'électricité est essentielle pour que le processus électrolytique se déroule efficacement. La rigidité diélectrique élevée du quartz et sa faible perte électrique en font un matériau idéal pour les électrodes et les autres composants électriques de la cellule.
Pureté et transparence
Le quartz est très pur, avec une teneur en SiO2 d'au moins 99,9 %. Cette pureté élevée est essentielle dans des industries telles que la fabrication de semi-conducteurs, où même des quantités infimes d'impuretés peuvent nuire au processus. La transparence du quartz, de l'ultraviolet à l'infrarouge, permet également une meilleure surveillance et un meilleur contrôle du processus électrolytique, ce qui garantit des résultats de meilleure qualité.
Propriétés mécaniques et optiques
Le quartz présente des propriétés mécaniques exceptionnelles, notamment une rigidité, une élasticité et une résistance aux chocs élevées. Ces propriétés garantissent que les composants en quartz peuvent résister aux contraintes mécaniques rencontrées dans les cellules électrolytiques sans compromettre leur intégrité structurelle. En outre, les excellentes propriétés de transmission optique du quartz permettent une surveillance et un réglage précis du processus électrolytique, ce qui contribue à une efficacité et une précision accrues.
Applications dans les cellules électrolytiques
Les propriétés uniques du quartz lui permettent de s'adapter à une large gamme d'applications dans les cellules électrolytiques. Les tubes et tiges de quartz, par exemple, sont utilisés dans la fabrication des semi-conducteurs pour le nettoyage des bains après la gravure et l'usinage, ainsi que dans les tubes soumis à des traitements thermiques. Dans les laboratoires, le quartz est utilisé dans les jauges de visée, l'optique et divers procédés industriels où sa résistance aux chocs et son inertie chimique sont inestimables.
En conclusion, l'utilisation du quartz dans les cellules d'électrolyse met à profit ses propriétés supérieures, notamment sa résistance aux hautes températures, son inertie chimique, ses excellentes propriétés électriques et ses avantages mécaniques et optiques. Ces caractéristiques améliorent non seulement les performances et la longévité des cellules électrolytiques, mais contribuent également à la production de résultats de haute qualité dans diverses applications industrielles.
Comparaison avec d'autres types de cellules électrolytiques
Les cellules électrolytiques sont un type fondamental de cellule électrochimique, qui diffère considérablement des cellules galvaniques en ce qui concerne leur configuration, leur fonction et leurs utilisations typiques. Il est essentiel de comprendre ces différences pour sélectionner le type de cellule approprié pour des applications spécifiques dans la recherche et l'industrie.
Principales différences entre les cellules électrolytiques et galvaniques
-
Conversion de l'énergie:
- Cellules galvaniques: Ces cellules convertissent spontanément l'énergie chimique en énergie électrique. Elles sont alimentées par des réactions d'oxydoréduction qui se produisent naturellement, produisant un flux d'électrons de l'anode à la cathode par le biais d'un circuit externe. Les exemples incluent les batteries et les piles à combustible.
- Cellules électrolytiques: En revanche, les cellules électrolytiques nécessitent une source d'énergie électrique externe pour entraîner des réactions chimiques non spontanées. Elles sont utilisées dans des processus tels que l'électrolyse, où l'énergie électrique est utilisée pour décomposer des composés ou entraîner des réactions dans une direction souhaitée.
-
Spontanéité des réactions:
- Cellules galvaniques: Les réactions dans les cellules galvaniques sont spontanées, ce qui signifie qu'elles se produisent sans avoir besoin d'une source d'énergie externe une fois que la cellule est installée.
- Cellules électrolytiques: Les réactions dans les cellules électrolytiques ne sont pas spontanées et nécessitent l'apport d'énergie électrique pour se produire.
-
Polarités des électrodes:
- Cellules galvaniques: Dans les cellules galvaniques, l'anode est l'électrode négative où se produit l'oxydation, et la cathode est l'électrode positive où se produit la réduction.
- Cellules électrolytiques: Les polarités sont inversées dans les cellules électrolytiques. L'anode est positive et la cathode est négative, ce qui reflète la nécessité d'une source d'énergie externe pour forcer les électrons à aller à l'encontre de leur flux naturel.

Utilisations typiques des cellules électrolytiques et galvaniques
- Cellules galvaniques: Elles sont couramment utilisées dans les appareils courants tels que les piles (alcalines, lithium-ion, par exemple), les piles à combustible et les cellules solaires. Elles sont essentielles pour les appareils électroniques portables, car elles fournissent une source fiable d'énergie électrique par le biais de réactions chimiques spontanées.
- Cellules électrolytiques: Elles sont utilisées dans des processus industriels tels que la galvanoplastie (revêtement d'un métal sur un autre), l'électrolyse de l'eau (production d'hydrogène et d'oxygène) et l'affinage des métaux (par exemple, l'affinage du cuivre). Elles sont également essentielles à la production de produits chimiques tels que l'hydroxyde de sodium et le chlore par l'électrolyse de la saumure.
Différences structurelles
- Cellules galvaniques: Elles sont généralement constituées de deux solutions d'électrolytes différentes dans des récipients séparés, reliés par un pont salin pour maintenir la neutralité électrique. Les électrodes (anode et cathode) sont immergées dans ces solutions et un circuit externe permet la circulation des électrons.
- Cellules électrolytiques: Elles ont souvent une structure plus simple, les deux électrodes étant immergées dans une seule solution électrolytique. La source d'énergie externe est connectée aux électrodes pour alimenter le processus électrolytique.
Conclusion
Bien que les cellules électrolytiques et galvaniques soient des types de cellules électrochimiques et impliquent des réactions d'oxydoréduction, elles servent des objectifs fondamentalement différents en raison de la nature de leurs réactions et des conversions d'énergie qu'elles facilitent. Comprendre ces différences permet de sélectionner le type de cellule approprié pour des applications spécifiques, qu'il s'agisse de générer spontanément de l'énergie électrique ou d'entraîner des réactions chimiques grâce à l'apport d'énergie électrique.
Conclusion
En conclusion,cellules électrolytiques à quartz sont des composants essentiels des processus industriels modernes, qui tirent parti de leurs propriétés uniques pour faciliter des réactions chimiques précises et la production de métaux de haute pureté. Leur capacité à résister à des températures élevées et leur inertie chimique en font des alternatives supérieures dans diverses applications, de l'électrolyse de l'eau à la production pharmaceutique. Malgré les difficultés liées à la maintenance et à la dégradation des électrodes, la recherche en cours promet des innovations qui amélioreront leur efficacité et étendront leur utilité. Au fur et à mesure de l'évolution des industries, le rôle des cellules électrolytiques à quartz s'accroîtra sans aucun doute, soulignant leur importance dans l'avancement des processus technologiques et chimiques.
Produits associés
- Cellule électrochimique électrolytique en quartz pour expériences électrochimiques
- Cellule électrolytique électrochimique optique à fenêtre latérale
- Cellule électrolytique de type H Triple Cellule électrochimique
- Bain-marie électrochimique multifonctionnel pour cellule électrolytique, simple ou double couche
- Cellule électrolytique optique à double couche de type H avec bain-marie
Articles associés
- Le cœur de verre de l'expérience : la précision par des soins systématiques
- L'architecture de l'invisibilité : déconstruction de la cellule "tout quartz"
- Le Dialogue Silencieux : Maîtriser le Contrôle dans les Cellules Électrolytiques
- Le Vaisseau de Vérité : Pourquoi le Contenant Compte Plus que la Chimie
- La Variable Invisible : Pourquoi les Rituels Post-Expérimentaux Définissent la Vérité Scientifique