Table des matières
- Introduction à la préparation des échantillons XRF
- Taille des particules : La base d'une préparation réussie des pastilles
- La contamination : Le saboteur silencieux de l'analyse XRF
- Choix du liant : la clé de l'homogénéité des granulés
- Épaisseur des granulés : Assurer une profondeur d'échantillonnage suffisante
- Application de la pression : Équilibre entre compression et homogénéité
- Taux de dilution : Ajustement fin pour des résultats précis
- Contamination croisée entre échantillons : Prévention des interférences
- Meilleures pratiques pour la réduction des erreurs dans la préparation des pastilles XRF
- Conclusion : Atteindre la précision dans l'analyse XRF
Introduction à la préparation des échantillons XRF
Dans le domaine de l'analyse par fluorescence X (XRF), la précision de la préparation des échantillons est primordiale pour obtenir des résultats précis et fiables. Le pressage des pastilles joue un rôle crucial dans ce processus, en garantissant que les échantillons sont homogénéisés et prêts pour l'analyse. Cependant, des problèmes courants tels qu'une taille de particule inappropriée, une contamination, un mauvais choix de liant et une application inadéquate de la pression peuvent conduire à des erreurs significatives. Cet article se penche sur les pièges les plus fréquents de la PRÉPARATION D'ÉCHANTILLONS XRF par PRESSE PELLET et propose des solutions pratiques pour les surmonter, afin de vous permettre d'atteindre le plus haut niveau de précision dans vos analyses XRF.
Taille des particules : La base d'une préparation réussie des pastilles
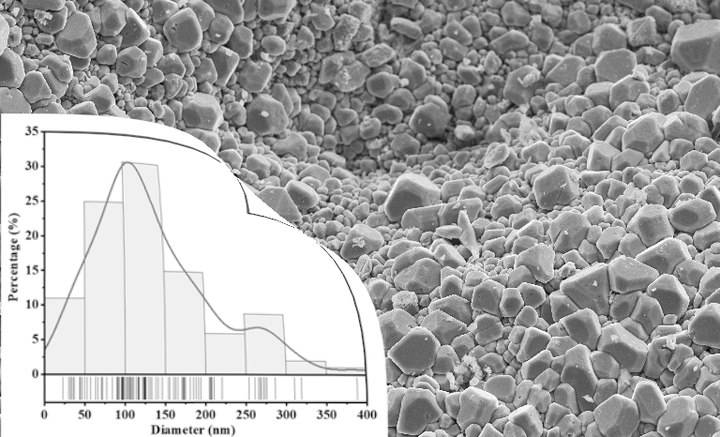
La taille des particules est un facteur critique dans la préparation des pastilles pressées, car elle a un impact significatif sur la précision et la fiabilité des résultats d'analyse. Il est essentiel d'obtenir une taille de particule idéale, généralement inférieure à 50 µm, pour plusieurs raisons. Tout d'abord, les particules de petite taille garantissent une meilleure homogénéité au sein de l'échantillon. Lorsque les particules sont trop grosses ou de taille différente, il peut en résulter des incohérences dans la distribution des éléments au sein du culot, ce qui peut fausser les données analytiques.
L'importance d'une taille de particule uniforme
L'uniformité de la taille des particules est primordiale pour plusieurs raisons. Des particules plus petites permettent un compactage et une liaison plus efficaces lorsque la pastille est pressée. Cette uniformité garantit que l'échantillon se comprime uniformément, ce qui permet d'obtenir des résultats d'analyse plus cohérents et plus fiables. En revanche, des particules plus grosses ou de taille variable peuvent créer des hétérogénéités dans la pastille, où différentes régions de la pastille peuvent contenir des concentrations différentes d'éléments. Cette hétérogénéité peut conduire à des lectures erronées, car l'équipement d'analyse peut ne pas échantillonner l'ensemble de la pastille de manière uniforme.
Atteindre la taille de particule idéale
Pour obtenir une taille de particule idéale inférieure à 50 µm, diverses techniques de laboratoire peuvent être employées. Les méthodes les plus courantes consistent à utiliser des concasseurs, des broyeurs et des moulins pour réduire la taille des particules de l'échantillon avant le pressage. Il est généralement considéré comme acceptable d'avoir un diamètre de particule de 40 µm ou moins. Ces techniques garantissent que l'échantillon est finement broyé, ce qui permet d'améliorer l'uniformité et la cohérence de la pastille finale.
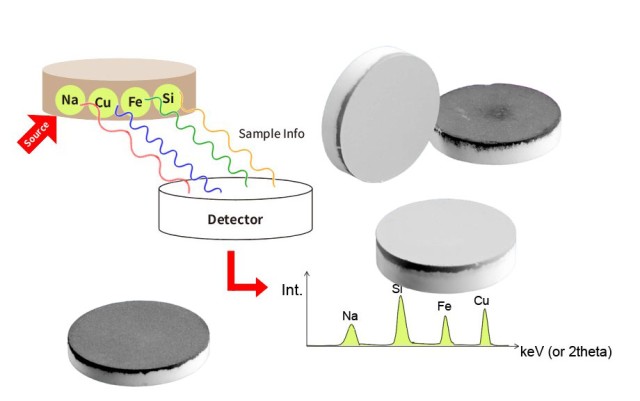
Impact de la taille des particules sur les résultats analytiques
On ne saurait trop insister sur l'impact de la taille des particules sur les résultats analytiques. Les particules de petite taille sont essentielles pour produire des pastilles qui donnent les meilleurs résultats d'analyse. Par exemple, dans l'analyse par fluorescence X (XRF), la profondeur d'échantillonnage ou la profondeur d'échappement critique pour les éléments dans un échantillon dépend de l'énergie. Les éléments à grande longueur d'onde tels que le sodium (Na) ont des profondeurs d'échappement plus faibles que les éléments à petite longueur d'onde tels que le fer (Fe). Cela signifie que l'analyse du Na n'échantillonne que les 10 premiers µm environ d'un échantillon. Par conséquent, toute hétérogénéité à l'intérieur de cette faible profondeur peut affecter de manière significative la précision de l'analyse.
En revanche, des particules de taille plus importante ou variable peuvent entraîner des hétérogénéités dans l'échantillon. Ces hétérogénéités peuvent se traduire par une distribution incohérente des éléments dans la pastille, ce qui entraîne un manque de fiabilité des données analytiques. Par exemple, si une pastille contient des régions avec des tailles de particules variables, l'équipement analytique peut ne pas échantillonner ces régions de manière uniforme, ce qui entraîne des divergences dans les concentrations mesurées des éléments.
Bonnes pratiques pour le contrôle de la taille des particules
Pour obtenir les meilleurs résultats analytiques possibles, il est essentiel de suivre les meilleures pratiques en matière de contrôle de la taille des particules. Il s'agit notamment d'utiliser des techniques de broyage et de concassage appropriées pour obtenir une taille de particule uniforme inférieure à 50 µm. Le souci du détail et la cohérence du processus de préparation sont également essentiels. En s'assurant que l'échantillon est broyé à la taille de particule idéale, les analystes peuvent minimiser le risque d'hétérogénéités et obtenir des résultats d'analyse plus précis et plus fiables.
En résumé, la taille des particules est la base d'une préparation réussie des pastilles. L'obtention et le maintien d'une taille de particule uniforme inférieure à 50 µm sont essentiels pour garantir l'homogénéité de l'échantillon, ce qui permet d'obtenir des résultats d'analyse plus précis et plus fiables. En suivant les meilleures pratiques et en accordant une attention particulière au processus de préparation, les analystes peuvent améliorer de manière significative la qualité de leurs données analytiques.
La contamination : Le saboteur silencieux de l'analyse XRF
La contamination est l'un des défis les plus importants de l'analyse par fluorescence X (XRF), en particulier au cours du processus de préparation de l'échantillon. L'étape du broyage est un point critique où la contamination peut facilement se produire, entraînant des résultats inexacts et trompeurs. Il est essentiel de comprendre les sources de contamination, de mettre en œuvre des méthodes de prévention efficaces et de reconnaître les conséquences de la contamination pour préserver l'intégrité de l'analyse par fluorescence X.
Sources de contamination
La contamination dans l'analyse XRF peut provenir de diverses sources, mais le processus de broyage est particulièrement vulnérable. Pendant le broyage, des composants externes de l'instrument de préparation de l'échantillon peuvent être introduits par inadvertance dans l'échantillon. Cela peut se produire si les outils de broyage ou les récipients ne sont pas correctement nettoyés entre les échantillons, ce qui entraîne une contamination croisée. Par exemple, les résidus des échantillons précédents peuvent rester sur les outils de broyage et être transférés au nouvel échantillon, modifiant ainsi sa composition élémentaire.
Une autre source fréquente de contamination est l'utilisation de matériaux inappropriés pour la préparation des échantillons. Par exemple, si les outils de broyage sont fabriqués dans des matériaux susceptibles de libérer des particules ou si les récipients ne sont pas inertes, ces matériaux peuvent introduire des éléments indésirables dans l'échantillon. En outre, des facteurs environnementaux tels que la poussière, l'humidité et les vapeurs chimiques dans le laboratoire peuvent contribuer à la contamination.
Méthodes de prévention de la contamination
La prévention de la contamination dans l'analyse XRF exige une attention méticuleuse aux détails et la mise en œuvre de protocoles rigoureux. L'une des méthodes les plus efficaces consiste à s'assurer que tous les outils de broyage et les récipients sont soigneusement nettoyés et stérilisés avant chaque utilisation. Pour ce faire, on peut utiliser des solvants ou des agents de nettoyage spécialisés qui sont compatibles avec les matériaux analysés.
Une autre stratégie consiste à utiliser des matériaux inertes pour les outils de broyage et les récipients. Des matériaux tels que le verre borosilicaté ou l'alumine de haute pureté sont moins susceptibles d'introduire des contaminants dans l'échantillon. En outre, il est important de travailler dans un environnement propre, de préférence dans une zone dédiée à la préparation des échantillons, exempte de poussière et d'autres contaminants potentiels.
Pour les échantillons de poudre, il est essentiel de préparer les cuvettes et les films avec soin. Il existe de nombreux types de films disponibles pour la fluorescence X, et il est essentiel de sélectionner le type le plus approprié pour une tâche et un appareil spécifiques. Consulter le fournisseur permet de s'assurer que le film choisi est adapté à l'échantillon et qu'il n'introduira pas de contaminants.

Conséquences de la contamination sur les résultats de l'analyse par fluorescence X
La contamination peut avoir de graves conséquences sur les résultats de l'analyse par fluorescence X, entraînant des données inexactes et peu fiables. Si un échantillon est contaminé au cours du processus de broyage, la composition élémentaire mesurée par l'instrument XRF sera incorrecte. Il peut en résulter des faux positifs ou négatifs, une mauvaise interprétation des données et, en fin de compte, des conclusions erronées.
Par exemple, si un échantillon destiné à être analysé pour sa teneur en plomb est contaminé par du calcium provenant d'un échantillon précédent, les résultats de l'analyse par fluorescence X peuvent indiquer une concentration de plomb artificiellement élevée. Cela pourrait conduire à un diagnostic erroné de la contamination par le plomb, avec des implications potentielles pour la conformité réglementaire et la santé publique.
En outre, la contamination peut également affecter la précision et la reproductibilité des mesures XRF. Si la contamination se produit lors de la préparation de plusieurs échantillons, la variabilité des résultats peut augmenter, ce qui rend difficile la comparaison des données entre différents échantillons. Cela peut nuire à la fiabilité de l'analyse et compromettre la validité des conclusions tirées des données.
Conclusion
La contamination est un saboteur silencieux dans l'analyse XRF, en particulier pendant le processus de broyage. Il est essentiel de comprendre les sources de contamination, de mettre en œuvre des méthodes de prévention efficaces et de reconnaître les conséquences de la contamination pour préserver la précision et la fiabilité des résultats de l'analyse XRF. En apportant un soin méticuleux à la préparation des échantillons, en utilisant des matériaux appropriés et en travaillant dans un environnement propre, les chercheurs peuvent minimiser le risque de contamination et garantir l'intégrité de leurs analyses XRF.
Choix du liant : la clé de l'homogénéité des pastilles
Le choix d'un liant approprié est un aspect critique de la préparation des pastilles, car il influence directement l'homogénéité et la stabilité de la pastille finale. Les liants servent de "colle" pour maintenir les particules d'échantillon ensemble, garantissant que le culot reste intact pendant l'analyse et ne contamine pas le spectromètre avec de la poudre libre. Les liants les plus couramment utilisés dans la préparation des pastilles sont des mélanges de cellulose et de cire, connus pour leur capacité à s'homogénéiser avec l'échantillon et à lier efficacement les particules entre elles au cours du processus de pressage.
Rôle des liants dans la préparation des granulés
Les liants jouent un rôle crucial dans le processus de granulation en facilitant la formation d'un granulé cohésif à partir d'un échantillon de poudre. Sans liant, les particules de l'échantillon n'adhéreraient pas les unes aux autres, ce qui donnerait une pastille lâche et instable qui pourrait facilement se briser ou contaminer le spectromètre. Le liant agit comme un support qui permet aux particules d'adhérer les unes aux autres, formant ainsi une pastille solide et uniforme qui peut être analysée sans interférence avec les particules non adhérentes.
Types courants de liants
Mélanges de cellulose et de cire
Les mélanges cellulose/cire sont les liants les plus utilisés dans la préparation des granulés en raison de leur efficacité et de leur facilité d'utilisation. Ces liants sont généralement ajoutés à l'échantillon dans des proportions de 20 à 30 %, en fonction des exigences spécifiques de l'analyse. Le composant cellulosique assure l'intégrité structurelle de la pastille, tandis que la cire garantit l'adhérence des particules entre elles. Cette combinaison permet la formation d'un granulé homogène, à la fois solide et stable.

Liants acryliques
Dans certains cas, les liants acryliques peuvent être utilisés comme alternative aux mélanges cellulose/cire. Cependant, les liants acryliques peuvent être plus difficiles à homogénéiser avec l'échantillon, nécessitant souvent un mélange manuel au lieu d'être ajoutés automatiquement pendant le broyage. Cela peut entraîner des incohérences dans le granulé final, car le liant peut ne pas se répartir uniformément dans l'échantillon.
Granulés pré-mélangés
Pour des raisons pratiques, certains liants sont disponibles sous forme de granulés pré-mélangés qui peuvent être ajoutés automatiquement au broyeur pendant le broyage. Ces granulés pré-mélangés garantissent que le liant est réparti uniformément dans l'échantillon, ce qui permet d'obtenir des résultats plus cohérents et plus fiables. Toutefois, le choix de la pastille pré-mélangée doit être soigneusement étudié pour s'assurer qu'elle est compatible avec l'échantillon spécifique analysé.
Sélection du liant le plus approprié
Le choix du liant le mieux adapté à un échantillon donné dépend de plusieurs facteurs, notamment du type d'échantillon, de la force souhaitée pour le culot et des exigences spécifiques de l'analyse. Voici quelques considérations clés à garder à l'esprit lors de la sélection d'un liant :
Type d'échantillon
Différents échantillons peuvent nécessiter différents types de liants. Par exemple, les échantillons difficiles à broyer ou contenant des phases difficiles à broyer peuvent bénéficier d'un liant capable de mieux s'homogénéiser avec l'échantillon et de maintenir les particules ensemble. Dans ce cas, un mélange de cellulose et de cire peut être plus efficace qu'un liant acrylique.
Résistance des granulés
La solidité du granulé final est un autre élément important à prendre en compte. Une pastille plus solide est moins susceptible de se briser lors de la manipulation ou de l'analyse, ce qui réduit le risque de contamination et améliore la précision des résultats. Les mélanges cellulose/cire sont généralement préférés pour leur capacité à créer des granulés solides et stables.
Exigences de l'analyse
Les exigences spécifiques de l'analyse, telles que le type de spectromètre utilisé ou la sensibilité de la mesure, peuvent également influencer le choix du liant. Par exemple, certains liants peuvent produire des granulés plus uniformes, mieux adaptés aux analyses à haute résolution, tandis que d'autres peuvent être plus efficaces pour prévenir la contamination.
Bonnes pratiques pour le choix du liant
Pour obtenir les meilleurs résultats possibles, il est important de suivre les meilleures pratiques lors de la sélection et de l'utilisation d'un liant. Voici quelques conseils pour vous aider à tirer le meilleur parti de votre classeur :
Testez plusieurs classeurs
Si possible, testez plusieurs liants avec votre échantillon afin de déterminer celui qui produit les résultats les plus cohérents et les plus fiables. Cela peut vous aider à identifier le liant optimal pour votre application spécifique.
Attention aux proportions
La proportion de liant par rapport à l'échantillon est cruciale pour obtenir un granulé homogène. Si l'on ajoute trop de liant, le granulé risque d'être trop dur et cassant, tandis que si l'on n'en ajoute pas assez, le granulé risque d'être faible et instable. En général, une proportion de 20 à 30 % de liant par rapport à l'échantillon est recommandée, mais cette proportion peut varier en fonction du liant et de l'échantillon.
Assurer une distribution uniforme
Quel que soit le type de liant utilisé, il est important de s'assurer que le liant est uniformément réparti dans l'échantillon. Ceci peut être réalisé en mélangeant soigneusement le liant avec l'échantillon ou en utilisant une pastille pré-mélangée. Une distribution inégale du liant peut entraîner des incohérences dans le culot final, ce qui affecte la précision de l'analyse.
Contrôle de la taille des particules
La taille des particules de l'échantillon peut également influencer l'efficacité du liant. Des particules plus grosses peuvent donner un granulé moins homogène, car le liant n'est pas en mesure de maintenir toutes les particules ensemble de manière efficace. Le broyage de l'échantillon pour obtenir une taille de particule cohérente peut contribuer à améliorer les performances du liant et à produire un granulé plus uniforme.
Conclusion
Le choix du liant est un facteur critique dans la préparation de pastilles homogènes et stables pour l'analyse. En sélectionnant le liant le mieux adapté à votre échantillon et en suivant les meilleures pratiques pour son utilisation, vous pouvez vous assurer que vos granulés sont cohérents, fiables et exempts de contamination. Que vous choisissiez un mélange de cellulose et de cire, un liant acrylique ou une pastille pré-mélangée, un examen attentif des facteurs mentionnés ci-dessus vous aidera à obtenir les meilleurs résultats possibles lors de votre analyse.
Épaisseur de la pastille : Assurer une profondeur d'échantillonnage suffisante
Dans l'analyse par fluorescence X (XRF), l'épaisseur de la pastille pressée est un facteur critique qui influence directement la précision et la fiabilité des résultats analytiques. La pastille doit être suffisamment épaisse pour que les rayons X produits dans l'échantillon puissent s'échapper sans être réabsorbés, ce qui permet une mesure précise des éléments présents. Cette section traite de l'importance de l'épaisseur de la pastille, de la manière de calculer l'épaisseur requise et des erreurs courantes qui peuvent conduire à des résultats inexacts.

Importance de l'épaisseur des granulés
Lors de la préparation des pastilles pressées pour l'analyse XRF, la première préoccupation est de s'assurer que l'épaisseur de la pastille est "infinie" par rapport au faisceau de rayons X pour tous les éléments mesurés. Cela signifie que l'épaisseur de la pastille doit être supérieure à la profondeur de fuite de l'élément le plus énergétique de l'échantillon. Si la pastille est trop fine, les rayons X produits dans l'échantillon peuvent être réabsorbés avant d'atteindre le détecteur, ce qui entraîne une sous-estimation de la concentration de l'élément.
La profondeur de fuite d'un élément dépend de son niveau d'énergie, les éléments à haute énergie ayant généralement des profondeurs de fuite plus importantes. Par exemple, les éléments ayant un numéro atomique élevé (par exemple, le fer, le cuivre) auront des profondeurs de fuite plus importantes que les éléments à faible énergie (par exemple, le sodium, le magnésium). Par conséquent, la pastille doit être suffisamment épaisse pour tenir compte de la plus grande profondeur de fuite des éléments concernés.
Calcul de l'épaisseur requise de la pastille
Pour déterminer l'épaisseur requise de la pastille, il est essentiel de prendre en compte la profondeur de fuite de l'élément le plus énergétique de l'échantillon. La profondeur de fuite peut être calculée à l'aide des coefficients d'absorption de masse des éléments présents dans l'échantillon. Le coefficient d'absorption de masse est une mesure de la capacité d'un matériau à absorber les rayons X et dépend du numéro atomique de l'élément et de l'énergie du rayonnement X.
En pratique, une pastille composée de 8 à 10 grammes d'échantillon pour une pastille de 32 mm de diamètre ou de 13 à 15 grammes d'échantillon pour une pastille de 40 mm de diamètre est généralement suffisante pour les éléments qui peuvent être mesurés par les instruments de fluorescence X dispersive en longueur d'onde (WDXRF) les plus puissants actuellement disponibles. Ces poids garantissent que la pastille est suffisamment épaisse pour empêcher la réabsorption des rayons X et fournir des résultats d'analyse précis.
Erreurs courantes concernant l'épaisseur des pastilles
L'une des erreurs les plus courantes dans la préparation des pastilles pressées est la sous-estimation de l'épaisseur requise. Cela peut se produire si l'épaisseur de la pastille n'est pas suffisante pour permettre la plus grande profondeur de fuite des éléments mesurés. En conséquence, les rayons X produits dans l'échantillon peuvent être réabsorbés, ce qui entraîne des mesures inexactes.
Une autre erreur courante consiste à ne pas tenir compte de la masse atomique moyenne de l'échantillon. La capacité d'absorption de l'échantillon est directement proportionnelle à sa masse atomique moyenne, ce qui signifie que les éléments plus lourds absorbent plus de rayons X que les éléments plus légers. Il est donc essentiel de tenir compte de la composition élémentaire moyenne de l'échantillon lors de la détermination de l'épaisseur requise des pastilles.
Considérations relatives à la contamination
Outre l'épaisseur des pastilles, la contamination est un autre facteur critique qui peut affecter la qualité de l'analyse XRF. La contamination peut se produire au cours du processus de broyage de l'échantillon et peut provenir du dispositif de préparation de l'échantillon ou d'une contamination croisée entre échantillons. Pour minimiser la contamination, il est essentiel d'utiliser un équipement propre et de veiller à ce que le processus de préparation de l'échantillon se déroule dans un environnement contrôlé.
Meilleures pratiques pour la préparation des pastilles
Pour garantir une analyse XRF précise et fiable, il est essentiel de suivre les meilleures pratiques pour la préparation des pastilles. Il s'agit notamment d'utiliser la quantité appropriée d'échantillon pour obtenir l'épaisseur de pastille requise, de sélectionner le liant adéquat et d'appliquer une pression constante pendant le processus de pressage. L'attention portée aux détails et la cohérence du processus de préparation sont essentielles pour minimiser les erreurs et obtenir des résultats analytiques de haute qualité.
En résumé, l'épaisseur de la pastille pressée est un facteur critique dans l'analyse XRF qui a un impact direct sur la précision et la fiabilité des résultats analytiques. En veillant à ce que la pastille soit suffisamment épaisse pour s'adapter à la plus grande profondeur de fuite des éléments mesurés et en suivant les meilleures pratiques pour la préparation de la pastille, les analystes peuvent obtenir des mesures précises et exactes des éléments présents dans l'échantillon.
Application de la pression : Équilibrer la compression et l'homogénéité
L'obtention d'une pression optimale pendant le pressage des pastilles est cruciale pour créer des pastilles de haute qualité, exemptes de vides et présentant des propriétés homogènes. Le processus consiste à appliquer la pression adéquate pour comprimer l'échantillon et recristalliser le liant, en veillant à ce que le produit final soit à la fois dense et homogène. Cette section aborde les aspects critiques de l'application de la pression, y compris les effets de la surpression et de la sous-pression, ainsi que les techniques permettant d'obtenir la pression optimale pour vos échantillons.
Importance d'une application correcte de la pression
L'objectif principal du pressage des granulés est d'éliminer les espaces vides à l'intérieur du granulé, qui peuvent affecter de manière significative l'intensité des éléments plus légers de votre échantillon. Une pastille bien comprimée doit être suffisamment dense pour empêcher la formation de vides internes et garantir une distribution uniforme de l'échantillon et du liant. Pour ce faire, il est essentiel d'appliquer une pression suffisante pour comprimer complètement l'échantillon et recristalliser le liant.
Expérimentation et plage de pression optimale
La recherche de la pression optimale pour votre échantillon spécifique passe par l'expérimentation. Commencez par appliquer une pression croissante à vos échantillons et observez l'intensité des éléments plus légers. La plupart des échantillons atteignent leur intensité maximale à des pressions comprises entre 25 et 35 tonnes métriques (T) pendant 1 à 2 minutes. Cette fourchette est un bon point de départ, mais les échantillons individuels peuvent nécessiter des ajustements en fonction de leurs propriétés spécifiques.

Éviter la surpression et la sous-pression
La surpression peut entraîner plusieurs problèmes, notamment le dépassement de la résistance à la rupture du compact, ce qui se traduit par des fissures ou un "écrêtage" où la partie supérieure de la pastille se sépare du reste. Des forces très élevées ne permettent pas nécessairement d'obtenir de meilleurs granulés et peuvent être plus néfastes que bénéfiques. D'autre part, une pression insuffisante peut laisser des espaces vides à l'intérieur du granulé, ce qui entraîne des résultats irréguliers et une baisse d'intensité pour les éléments plus légers.
Techniques pour une application optimale de la pression
-
Relâchement lent de la pression: Après avoir appliqué la pression nécessaire, il faut la relâcher lentement pour éviter que la surface de la pastille ne se fissure. Un relâchement rapide de la pression peut provoquer des fractures sous contrainte, compromettant ainsi l'intégrité de la pastille.
-
Alignement et chargement de la filière: Veillez à ce que votre presse et votre matrice soient correctement alignées afin d'appliquer une pression uniforme. Le fait de trop remplir le manchon de la matrice avec de la poudre peut entraîner une compression inégale et doit être évité. Chargez la filière à 50 % maximum de la limite d'élasticité de l'acier pour éviter de dépasser sa capacité.
-
Dimensions des granulés: Maintenir un rapport équilibré entre la hauteur et le diamètre du granulé. Les granulés qui sont beaucoup plus longs que leur diamètre peuvent subir des contraintes plus importantes près du piston supérieur, ce qui peut entraîner des fissures. Si vous pressez des granulés plus longs, envisagez d'utiliser des forces plus faibles, de lubrifier la filière et d'utiliser un joint torique entre la plaque de base et le manchon pour répartir les contraintes de manière plus homogène.
-
Distribution uniforme de la poudre: Lors du transfert de l'échantillon dans la cavité de la filière, veillez à ce qu'il soit réparti uniformément. Une répartition inégale peut entraîner une compression irrégulière et la formation de vides dans la pastille.
Étapes pratiques pour l'application de la pression
- Fixer la presse à granulés: Fixer la filière dans la cavité de la presse et s'assurer qu'elle est correctement alignée.
- Transférer l'échantillon: Utilisez une spatule métallique pour répartir uniformément le mélange d'échantillons broyés dans la cavité de la presse.
- Distribuer les particules: Insérez la presse à boulons et faites-la tourner pour répartir les particules uniformément.
- Fixer le jeu de matrices: Transférer la filière dans la presse à granulés hydraulique et la fixer fermement en tournant la roue.
- Appliquer la pression: Fermez la vanne de la presse hydraulique et tirez sur le niveau pour appliquer la pression jusqu'à ce que la poignée soit serrée.
- Relâcher la pression: Pour libérer la matrice, il faut d'abord relâcher la pression, puis remonter la roue supérieure de la presse et enfin retirer la matrice.
En équilibrant soigneusement la compression et l'homogénéité, vous pouvez obtenir des granulés de haute qualité qui répondent à vos exigences expérimentales. Une application correcte de la pression, combinée à une attention particulière à chaque étape du processus, garantit que vos granulés sont denses, exempts de vides et présentent des propriétés constantes.
Taux de dilution : Un réglage précis pour des résultats exacts
Le taux de dilution joue un rôle essentiel dans l'analyse par fluorescence X (XRF), car il influence la précision et la fiabilité des résultats. Il est essentiel de déterminer et d'appliquer correctement le rapport de dilution approprié pour atténuer les problèmes courants liés à la préparation de l'échantillon et aux effets de matrice, en veillant à ce que la composition élémentaire de l'échantillon soit représentée avec précision.

Impact du taux de dilution sur l'analyse XRF
Dans l'analyse XRF, le taux de dilution affecte directement l'intensité des lignes de rayons X émises par l'échantillon. Un taux de dilution bien choisi peut équilibrer les effets de matrice, tels que l'absorption et le renforcement, qui peuvent fausser les intensités mesurées. L'absorption se produit lorsque les éléments de l'échantillon absorbent les rayons X émis par d'autres éléments, réduisant ainsi l'intensité des rayons X qui atteignent le détecteur. Le renforcement, quant à lui, se produit lorsque la présence d'éléments à haute énergie dans l'échantillon excite les atomes de l'élément analysé, augmentant ainsi l'intensité des raies de rayons X.
En choisissant soigneusement le taux de dilution, ces effets de matrice peuvent être minimisés, ce qui permet d'obtenir des résultats plus précis et reproductibles. Un rapport de dilution approprié garantit que l'échantillon n'est ni trop concentré, ce qui peut entraîner une absorption excessive, ni trop dilué, ce qui peut entraîner des intensités de signal faibles difficiles à mesurer avec précision.
Détermination du taux de dilution approprié
La détermination du taux de dilution approprié implique une combinaison de considérations théoriques et d'expériences pratiques. L'objectif est d'obtenir un mélange homogène dans lequel l'échantillon est uniformément réparti dans le matériau de la matrice. Voici quelques étapes clés à suivre :
-
Comprendre la composition de l'échantillon: Commencez par bien comprendre la composition élémentaire de votre échantillon. Il s'agit notamment de connaître les concentrations des éléments majeurs, mineurs et traces présents. Ces informations sont cruciales pour prévoir les effets potentiels de la matrice.
-
Sélectionner un matériau matriciel approprié: Le matériau de la matrice doit être chimiquement inerte et avoir une composition qui minimise les effets d'absorption et de renforcement. Les choix courants comprennent le tétraborate de lithium (LiBO₂) et l'acide borique (H₃BO₃), qui sont connus pour leur capacité à former des mélanges stables et homogènes avec un large éventail de types d'échantillons.
-
Effectuer des dilutions préliminaires: Commencez par une série de taux de dilution et mesurez les intensités obtenues. Utilisez ces mesures pour évaluer l'impact des différents rapports sur l'intensité des raies des rayons X. Recherchez un rapport où les intensités sont stables et où les effets de matrice sont minimisés.
-
Optimiser l'homogénéité: Veillez à ce que l'échantillon soit finement broyé jusqu'à une taille de grain inférieure à 75 µm. Ceci est essentiel pour obtenir un mélange homogène, ce qui est crucial pour une analyse XRF précise. Plus les grains sont fins, meilleur sera le mélange, ce qui réduira la probabilité d'apparition de vides et de surfaces irrégulières dans la pastille finale.
-
Évaluer la stabilité et la reproductibilité: Une fois qu'un taux de dilution approprié a été identifié, effectuez plusieurs mesures pour garantir la stabilité et la reproductibilité. Des variations dans les résultats peuvent indiquer des problèmes dans le processus de préparation de l'échantillon, tels qu'un mélange incomplet ou des variations dans la taille des grains.
Problèmes courants liés à une mauvaise dilution
Une mauvaise dilution peut entraîner plusieurs problèmes courants dans l'analyse XRF :
-
Absorption excessive: Les échantillons trop concentrés peuvent entraîner une absorption excessive, c'est-à-dire que les rayons X émis par l'échantillon sont fortement absorbés par d'autres éléments dans l'échantillon. Cela peut conduire à une sous-estimation des concentrations de certains éléments.
-
Faibles intensités de signal: À l'inverse, les échantillons sous-concentrés peuvent donner lieu à des signaux de faible intensité, ce qui rend difficile l'obtention de mesures précises. Ceci est particulièrement problématique pour les oligo-éléments, qui peuvent ne pas produire un signal suffisamment fort pour être détecté de manière fiable.
-
Effets de la matrice: Une mauvaise dilution peut exacerber les effets de matrice, tels que l'absorption et le renforcement. Ces effets peuvent fausser les intensités mesurées et conduire à des résultats inexacts.
-
Mélanges inhomogènes: Si l'échantillon n'est pas finement broyé ou si le taux de dilution n'est pas optimisé, le mélange obtenu peut être inhomogène. Cela peut entraîner des variations dans les intensités mesurées, même au sein d'un même échantillon, ce qui réduit la fiabilité des résultats.
Conclusion
Le réglage précis du taux de dilution est une étape essentielle pour obtenir des résultats d'analyse XRF précis et fiables. En sélectionnant soigneusement le taux de dilution approprié et en garantissant un mélange homogène, vous pouvez minimiser les effets de matrice et d'autres problèmes courants liés à la préparation de l'échantillon. Cette approche améliore non seulement la précision de vos mesures, mais aussi la reproductibilité de vos résultats, ce qui facilite la comparaison des données entre différents échantillons et expériences.
Contamination croisée entre échantillons : Prévenir les interférences
La contamination croisée entre échantillons est un problème critique dans les laboratoires d'analyse, qui peut conduire à des résultats inexacts et compromettre l'intégrité des données. Cette section examine les méthodes permettant de minimiser la contamination croisée, l'importance des protocoles de nettoyage et les meilleures pratiques pour garantir la pureté des échantillons.
Comprendre la contamination croisée
La contamination croisée se produit lorsque les résidus d'un échantillon interfèrent avec l'analyse d'un autre, ce qui fausse les résultats. Ce phénomène est particulièrement problématique dans les environnements où un large éventail de types d'échantillons est analysé, car le risque de contamination augmente avec la diversité des échantillons. Par exemple, si un dispositif de préparation d'échantillons tel qu'un pulvérisateur n'est pas soigneusement nettoyé entre deux utilisations, il peut introduire des éléments d'un échantillon dans le suivant, faussant ainsi l'analyse.

Méthodes pour minimiser la contamination croisée
-
Utilisation d'équipements dédiés: Une méthode efficace pour minimiser la contamination croisée consiste à utiliser un équipement dédié à des types d'échantillons spécifiques. Cela permet de s'assurer que les résidus d'un type d'échantillon n'interfèrent pas avec un autre. Par exemple, un pulvérisateur dédié aux échantillons métalliques peut empêcher l'introduction d'éléments métalliques dans des échantillons non métalliques.
-
Protocoles de nettoyage minutieux: Il est essentiel de mettre en œuvre des protocoles de nettoyage rigoureux. Après chaque utilisation, l'équipement doit être nettoyé selon une procédure normalisée. Il s'agit notamment d'utiliser des solvants ou des agents de nettoyage appropriés et de veiller à ce que tous les résidus soient éliminés. Par exemple, les récipients de broyage en acier doivent être nettoyés avec des solvants capables de dissoudre les résidus de fer, de nickel et de chrome.
-
Techniques de préparation des échantillons: La technique utilisée pour la préparation des échantillons peut également influencer le risque de contamination croisée. Par exemple, lors de la préparation des normes d'étalonnage pour l'analyse XRF, il est essentiel de faire correspondre la matrice des normes d'étalonnage à celle des échantillons. Cela permet d'améliorer la précision et de réduire le risque de contamination. En outre, l'utilisation de blancs d'étalonnage de haute qualité accompagnés d'un certificat d'analyse permet de garantir l'intégrité du processus d'étalonnage.
-
Utilisation de porte-échantillons: Pour les échantillons plus petits et plus fins, l'utilisation d'un porte-échantillon permet d'éviter l'interférence d'objets situés derrière l'échantillon. Cela garantit une analyse plus précise en maintenant une distance constante entre l'échantillon et la fenêtre de détection du spectromètre.
-
Mesures de surfaces multiples: Lors de l'analyse d'échantillons métalliques de grande taille, il est conseillé de mesurer plusieurs fois plusieurs surfaces afin d'obtenir des résultats plus précis. Cela permet de réduire la probabilité que les données soient faussées en raison d'une contamination localisée sur une seule surface.
Importance des protocoles de nettoyage
Les protocoles de nettoyage sont la clé de voûte de la prévention de la contamination croisée. Ils garantissent que l'équipement est exempt de résidus susceptibles d'interférer avec les analyses ultérieures. Un entretien régulier et le respect des procédures opérationnelles normalisées (POS) pour le démarrage et l'arrêt sont essentiels. Par exemple, des contrôles fréquents des instruments pour s'assurer qu'ils fonctionnent comme prévu permettent d'éviter les problèmes susceptibles d'entraîner une contamination.
Bonnes pratiques pour la préparation des échantillons
Les principaux objectifs de la préparation des échantillons sont de garantir l'homogénéité de l'échantillon et de gérer les interférences potentielles par rapport à la forme originale de l'échantillon. Les techniques qui offrent des avantages en termes de rapidité et de nombre d'échantillons pouvant être préparés en même temps sont particulièrement précieuses dans les laboratoires à haut débit. Toutefois, il est essentiel de trouver un équilibre entre la rapidité et le besoin de précision et d'intégrité.
Conclusion
La prévention de la contamination croisée d'un échantillon à l'autre est essentielle pour maintenir la précision et la fiabilité des résultats analytiques. En mettant en œuvre des équipements dédiés, des protocoles de nettoyage rigoureux et les meilleures pratiques en matière de préparation des échantillons, les laboratoires peuvent réduire de manière significative le risque de contamination. Cela permet non seulement de garantir l'intégrité des analyses individuelles, mais aussi de contribuer à la crédibilité globale des données du laboratoire.
Meilleures pratiques pour la réduction des erreurs dans la préparation des pastilles XRF
Lorsqu'il s'agit d'analyse par fluorescence X (XRF), la qualité des résultats dépend fortement de la préparation des échantillons. Le processus de création de pastilles pressées pour l'analyse XRF est une étape critique qui peut avoir un impact significatif sur la précision et la fiabilité des données. Pour minimiser les erreurs et garantir des résultats cohérents, il est essentiel de suivre les meilleures pratiques en matière de préparation des pastilles XRF. Cette section présente des stratégies clés pour le développement de méthodes, l'attention portée aux détails et la cohérence afin de réduire les erreurs dans la préparation des échantillons XRF.
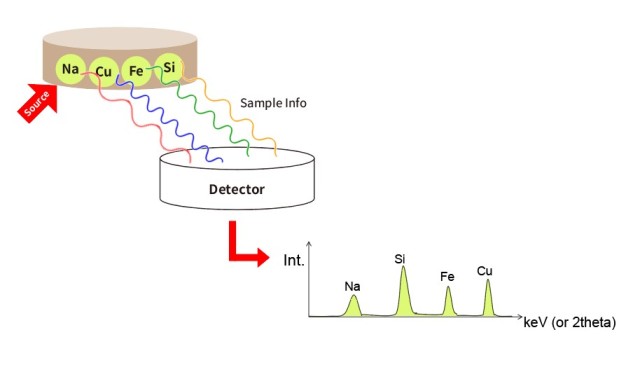
Élaboration de la méthode
La première étape pour réduire les erreurs dans la préparation des pastilles XRF est le développement d'une méthode robuste. Cela implique de comprendre les exigences spécifiques de l'échantillon analysé et d'adapter le processus de préparation en conséquence. La gamme des types d'échantillons pour l'analyse XRF est vaste, et chaque échantillon peut avoir des caractéristiques uniques qui nécessitent des ajustements dans la méthode de préparation. Par exemple, la taille des particules de l'échantillon, le choix du liant et le taux de dilution sont des facteurs critiques qui doivent être soigneusement pris en compte.
-
Taille des particules: La taille des particules de l'échantillon peut affecter de manière significative l'homogénéité de la pastille et, par conséquent, la précision de l'analyse XRF. Il est généralement recommandé d'utiliser une taille de particule inférieure à 100 micromètres pour assurer une distribution uniforme de l'échantillon dans la pastille. Des particules plus grosses peuvent entraîner une hétérogénéité, ce qui se traduit par des lectures incohérentes.
-
Choix du liant: Le liant utilisé dans le processus de préparation des pastilles joue un rôle crucial en garantissant l'intégrité et la stabilité des pastilles. Les liants les plus courants sont les verres de borate, la cellulose et les cires. Le choix du liant doit être basé sur la compatibilité avec l'échantillon et les exigences spécifiques de l'analyse XRF. Par exemple, certains liants peuvent introduire des éléments susceptibles d'interférer avec l'analyse, il est donc essentiel de choisir un liant qui minimise ces interférences.
-
Rapport de dilution: Le taux de dilution fait référence à la proportion de l'échantillon par rapport au liant. Un rapport de dilution adéquat garantit que l'échantillon est réparti uniformément dans la pastille, ce qui réduit le risque de sur- ou de sous-représentation de certains éléments. Le taux de dilution optimal dépend de la composition de l'échantillon et des exigences analytiques. Il est souvent nécessaire d'effectuer une série de tests pour déterminer le meilleur taux de dilution pour un échantillon donné.
Le souci du détail
Le souci du détail est primordial dans la préparation des pastilles XRF afin de minimiser les erreurs. De petites déviations dans le processus de préparation peuvent entraîner des écarts importants dans les résultats de l'analyse. Il est donc essentiel de maintenir une cohérence à chaque étape du processus de préparation.
-
Application de la pression: La pression appliquée pendant le processus de pressage des granulés est un facteur critique qui affecte la densité et l'homogénéité des granulés. Une pression insuffisante peut conduire à un culot lâche, tandis qu'une pression excessive peut entraîner une compression irrégulière de l'échantillon. La pression optimale doit être déterminée en fonction des propriétés de l'échantillon et des exigences spécifiques de l'analyse XRF. La constance de la pression appliquée est essentielle pour garantir des résultats reproductibles.
-
Épaisseur de la pastille: L'épaisseur de la pastille finale peut influencer la sensibilité et la précision de l'analyse XRF. Une pastille trop fine peut ne pas fournir un signal suffisant, tandis qu'une pastille trop épaisse peut entraîner des effets d'absorption qui faussent les résultats. L'épaisseur idéale se situe généralement entre 1 et 3 millimètres, en fonction de la composition de l'échantillon et des exigences analytiques.
-
Contamination croisée entre échantillons: La contamination croisée entre les échantillons est une source d'erreur courante dans l'analyse XRF. Pour minimiser ce risque, il est essentiel de nettoyer soigneusement tous les équipements et toutes les surfaces entre les préparations d'échantillons. Cela inclut la presse à granulés, les conteneurs d'échantillons et tout autre outil utilisé au cours du processus. En outre, l'utilisation d'outils dédiés à chaque échantillon peut réduire davantage le risque de contamination croisée.
Cohérence
La cohérence du processus de préparation est essentielle pour réduire les erreurs dans l'analyse XRF. Cela implique d'établir des procédures opératoires normalisées (POS) et d'effectuer régulièrement des contrôles de qualité (CQ) et d'assurance qualité (AQ).
-
Procédures opératoires normalisées (POS): L'élaboration et le respect des modes opératoires normalisés garantissent que chaque étape du processus de préparation est exécutée de manière cohérente. Les modes opératoires normalisés doivent comprendre des instructions détaillées pour la préparation des échantillons, notamment en ce qui concerne la taille des particules, le choix du liant, le taux de dilution, l'application de la pression et l'épaisseur des granulés. Une formation et une documentation régulières du processus de préparation peuvent contribuer à garantir que l'ensemble du personnel respecte les modes opératoires normalisés de manière cohérente.
-
Contrôle de la qualité (CQ) et assurance de la qualité (AQ): Les procédures de CQ et d'AQ sont essentielles pour contrôler la précision et la fiabilité de l'analyse XRF. Elles comprennent l'utilisation de matériaux de référence certifiés (CRM), de blancs, de duplicatas et de réplicatas pour vérifier l'exactitude des résultats. Des contrôles CQ réguliers permettent d'identifier tout écart par rapport aux résultats attendus et d'ajuster le processus de préparation en temps utile.
-
Correspondance des matrices: La mise en correspondance des matrices consiste à préparer des échantillons dont la composition est similaire à celle des échantillons inconnus afin de minimiser les effets de matrice. Cela permet de réduire les erreurs causées par des différences dans la composition de l'échantillon, telles que les effets d'absorption ou de renforcement. L'adaptation de la matrice est particulièrement importante lors de l'analyse d'échantillons complexes dont la composition varie.
Conclusion
En conclusion, la réduction des erreurs dans la préparation des pastilles XRF nécessite une combinaison de développement de méthodes, d'attention aux détails et de cohérence. En examinant attentivement des facteurs tels que la taille des particules, le choix du liant, le taux de dilution, l'application de la pression et l'épaisseur des pastilles, en établissant des modes opératoires normalisés et en effectuant des contrôles réguliers de qualité et d'assurance qualité, il est possible de minimiser les erreurs et de garantir des résultats d'analyse XRF précis et fiables. La clé d'une analyse XRF réussie réside dans la préparation méticuleuse des échantillons, car même de petites déviations peuvent entraîner des écarts importants dans les résultats finaux.
Conclusion : Atteindre la précision dans l'analyse XRF
Pour obtenir des résultats précis, il est essentiel de maîtriser la préparation des échantillons pour l'analyse XRF par presse à granulés. En abordant des questions courantes telles que la taille des particules, la contamination, le choix du liant, l'épaisseur des granulés, l'application de la pression, le taux de dilution et la contamination croisée, vous pouvez améliorer de manière significative la précision de votre analyse XRF. Le respect des meilleures pratiques et l'attention méticuleuse portée aux détails garantissent l'optimisation de chaque aspect de la préparation des pastilles, ce qui permet d'obtenir des résultats d'analyse fiables et cohérents. Investir du temps dans le perfectionnement de vos techniques de préparation vous permettra d'obtenir des données plus précises et une meilleure compréhension de vos échantillons.
CONTACTEZ-NOUS POUR UNE CONSULTATION GRATUITE
Les produits et services de KINTEK LAB SOLUTION ont été reconnus par des clients du monde entier. Notre personnel se fera un plaisir de répondre à toute demande que vous pourriez avoir. Contactez-nous pour une consultation gratuite et parlez à un spécialiste produit pour trouver la solution la plus adaptée aux besoins de votre application !