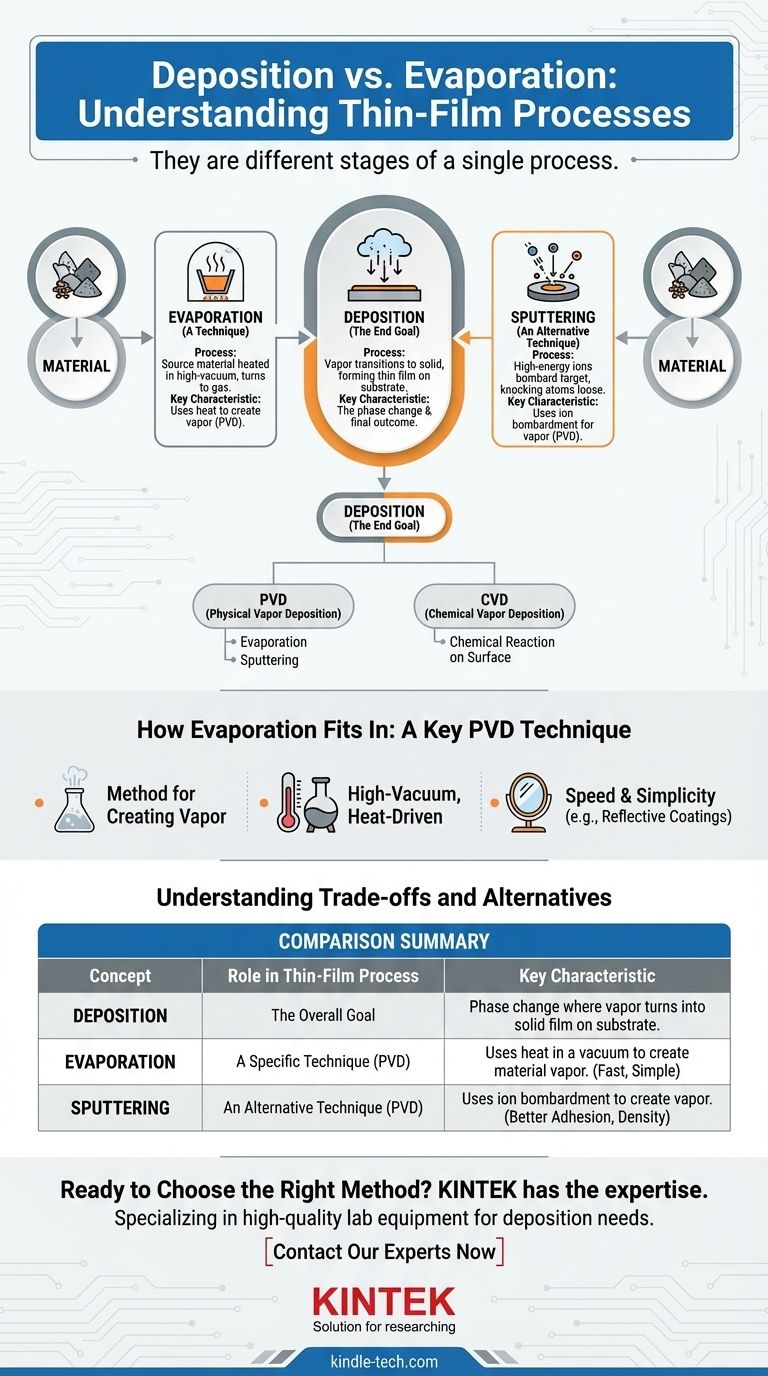
Non, le dépôt et l'évaporation ne sont pas la même chose. Ils représentent deux étapes différentes d'un processus global unique. Le dépôt est le résultat final d'un matériau se déposant sur une surface, tandis que l'évaporation est une technique spécifique utilisée pour amener le matériau à l'état de vapeur afin que le dépôt puisse avoir lieu.
Considérez le dépôt comme l'objectif général : appliquer un film mince de matériau sur un substrat. L'évaporation n'est qu'un des outils, ou techniques, que vous pouvez utiliser pour atteindre cet objectif, aux côtés d'autres méthodes comme la pulvérisation cathodique (sputtering).

Qu'est-ce que le dépôt ? L'objectif final
Le processus fondamental
Le dépôt est un processus où un matériau à l'état gazeux ou vapeur passe à l'état solide, formant un film mince et stable sur une surface (appelée substrat). C'est fondamentalement un changement de phase.
L'objectif principal
L'objectif principal du dépôt est de créer une couche de matériau hautement contrôlée. Ces films minces sont des composants essentiels dans la fabrication de semi-conducteurs, de lentilles optiques, de miroirs et d'innombrables autres technologies de pointe.
Deux grandes catégories
Presque toutes les techniques de dépôt appartiennent à l'une des deux familles : le dépôt physique en phase vapeur (PVD) et le dépôt chimique en phase vapeur (CVD). Cette distinction est basée sur la manière dont le matériau est préparé avant d'atteindre le substrat.
Comment l'évaporation s'intègre : une technique PVD clé
L'évaporation comme méthode
L'évaporation est une technique fondamentale au sein de la famille du dépôt physique en phase vapeur (PVD). C'est une méthode pour créer la vapeur qui sera finalement déposée.
Le mécanisme
Dans ce processus, un matériau source (comme l'aluminium ou l'or) est chauffé dans une chambre à vide poussé. La chaleur provoque l'ébullition ou la sublimation du matériau, le transformant directement en gaz. Cette vapeur voyage ensuite à travers le vide et se condense sur un substrat plus froid, formant le film solide souhaité.
Applications courantes
L'évaporation thermique est souvent choisie pour sa rapidité et sa simplicité. Elle est largement utilisée pour créer des revêtements réfléchissants sur les miroirs, métalliser les plastiques et former des contacts électriques dans des dispositifs électroniques simples.
Comprendre les compromis et les alternatives
La pulvérisation cathodique (Sputtering) : l'autre technique PVD majeure
La pulvérisation cathodique est une autre méthode PVD courante. Au lieu de la chaleur, elle utilise des ions à haute énergie pour bombarder une cible constituée du matériau source. Ce bombardement détache physiquement des atomes, qui voyagent ensuite et se déposent sur le substrat.
Différence clé : Évaporation vs Pulvérisation cathodique
Comme le note votre référence, la pulvérisation cathodique est souvent plus lente que l'évaporation. Cependant, elle peut produire des films avec une meilleure adhérence et densité. Le choix entre les deux dépend entièrement des propriétés requises du film final.
Qu'en est-il du dépôt chimique en phase vapeur (CVD) ?
Il est important de distinguer les méthodes PVD comme l'évaporation du CVD. En CVD, des gaz précurseurs sont introduits dans une chambre, et ils subissent une réaction chimique directement sur la surface chaude du substrat. C'est cette réaction qui forme le film solide, plutôt qu'une simple condensation.
Faire le bon choix pour votre objectif
Pour parler de ces processus avec précision, il est crucial d'utiliser le bon terme pour le bon contexte.
- Si votre objectif principal est le processus global : Utilisez le terme dépôt pour décrire l'acte général de création d'un film mince sur une surface.
- Si votre objectif principal est la technique spécifique : Utilisez le terme évaporation ou pulvérisation cathodique pour expliquer exactement comment la vapeur du matériau est générée.
- Si votre objectif principal est la catégorisation : N'oubliez pas que l'évaporation est un type de dépôt physique en phase vapeur (PVD), une classe majeure de technologie de dépôt.
Comprendre cette hiérarchie — le dépôt comme objectif et l'évaporation comme l'une des méthodes — clarifie tout le paysage de la technologie des films minces.
Tableau récapitulatif :
| Concept | Rôle dans le processus de film mince | Caractéristique clé |
|---|---|---|
| Dépôt | L'objectif global | Le changement de phase où la vapeur se transforme en film solide sur un substrat. |
| Évaporation | Une technique spécifique (PVD) | Utilise la chaleur dans un vide pour créer de la vapeur de matériau pour le dépôt. |
| Pulvérisation cathodique (Sputtering) | Une technique alternative (PVD) | Utilise le bombardement ionique pour créer de la vapeur, souvent pour une meilleure adhérence du film. |
Prêt à choisir la bonne méthode de dépôt de film mince pour votre projet ?
Comprendre les nuances entre le dépôt, l'évaporation et la pulvérisation cathodique est essentiel pour obtenir les propriétés de film précises que votre application exige. Que vous ayez besoin de la vitesse de l'évaporation thermique ou de l'adhérence supérieure de la pulvérisation cathodique, KINTEK possède l'expertise et l'équipement pour soutenir la recherche et la production de films minces de votre laboratoire.
Nous nous spécialisons dans la fourniture d'équipements de laboratoire et de consommables de haute qualité pour tous vos besoins de dépôt. Contactez-nous dès aujourd'hui pour discuter de la manière dont nos solutions peuvent améliorer l'efficacité de votre processus et la qualité de votre film.
Contactez nos experts maintenant
Guide Visuel
Produits associés
- Système RF PECVD Dépôt chimique en phase vapeur assisté par plasma à radiofréquence RF PECVD
- Système de chambre de dépôt chimique en phase vapeur CVD Équipement Four tubulaire PECVD avec gazéificateur liquide Machine PECVD
- Bateau d'évaporation de molybdène, tungstène et tantale pour applications à haute température
- Bateau d'évaporation en tungstène-molybdène à fond hémisphérique
- Bateau d'évaporation en céramique aluminisée pour le dépôt de couches minces
Les gens demandent aussi
- Comment fonctionne le dépôt en phase vapeur par plasma ? Une solution de revêtement à basse température pour les matériaux sensibles
- Comment l'énergie RF crée-t-elle le plasma ? Obtenez un plasma stable et à haute densité pour vos applications
- Pourquoi le PECVD est-il respectueux de l'environnement ? Comprendre les avantages écologiques du revêtement assisté par plasma
- Pourquoi le PECVD utilise-t-il couramment une alimentation RF ? Pour un dépôt de couches minces de précision à basse température
- Qu'est-ce que la méthode de dépôt chimique en phase vapeur activée par plasma ? Une solution à basse température pour les revêtements avancés



















