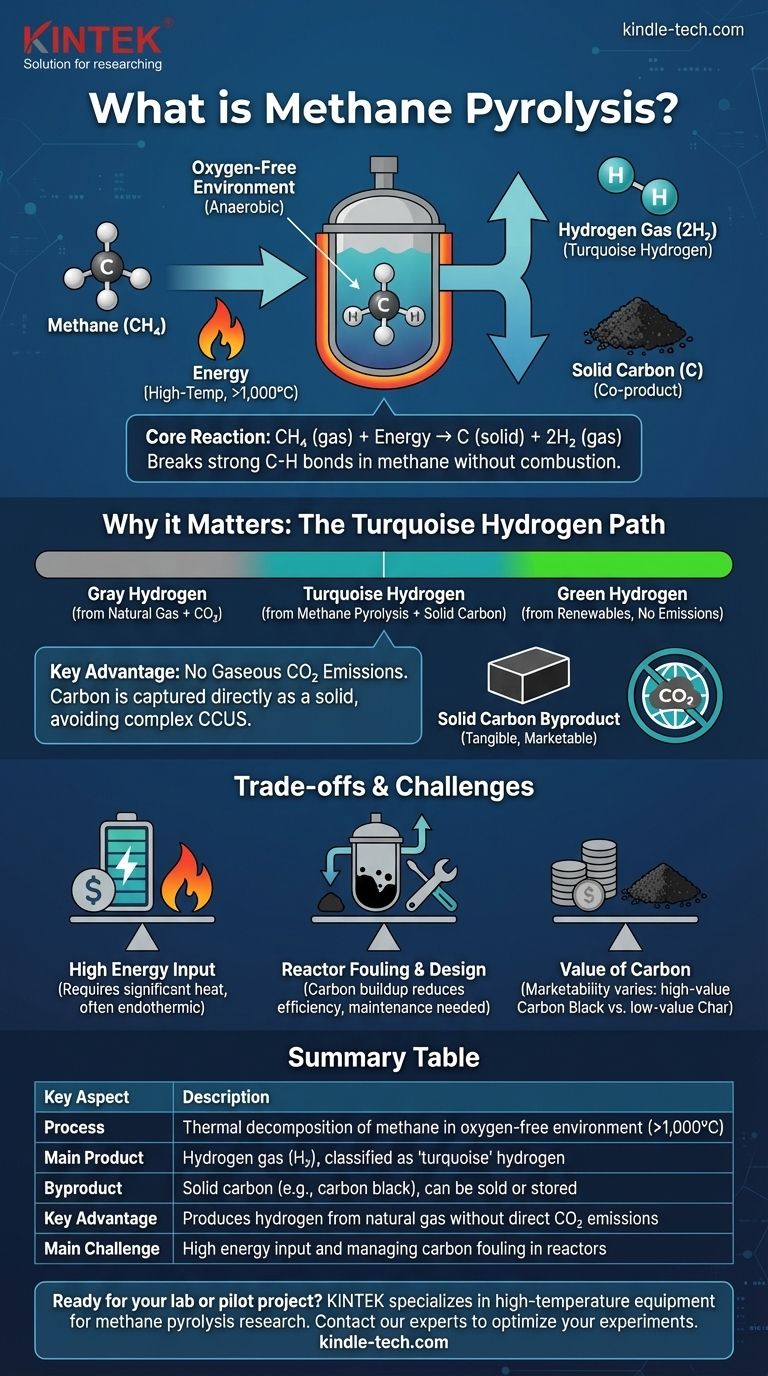
En termes simples, la pyrolyse du méthane est un processus chimique qui décompose le méthane (CH₄) en ses composants fondamentaux : le gaz d'hydrogène (H₂) et le carbone solide (C). Elle y parvient en chauffant le méthane à très hautes températures dans un environnement sans oxygène. Cette absence d'oxygène est essentielle, car elle empêche le méthane de brûler et le force plutôt à se décomposer.
La pyrolyse du méthane n'est pas seulement une réaction chimique ; c'est une stratégie pour produire de l'hydrogène précieux à partir du gaz naturel sans libérer de dioxyde de carbone dans l'atmosphère. Le carbone est capturé sous une forme solide et gérable, modifiant fondamentalement le profil d'émissions de la production d'hydrogène à partir de combustibles fossiles.

La réaction chimique fondamentale
L'élégance de la pyrolyse du méthane réside dans sa simplicité. Le processus, également connu sous le nom de craquage ou de décomposition du méthane, repose sur l'énergie thermique pour briser l'une des liaisons simples les plus fortes en chimie organique.
L'équation fondamentale
La réaction est régie par une équation simple et propre : CH₄ (gaz) + Énergie → C (solide) + 2H₂ (gaz). Une molécule de méthane produit un atome de carbone solide et deux molécules de gaz d'hydrogène.
Le rôle de la haute température
La rupture des liaisons carbone-hydrogène stables dans le méthane nécessite un apport énergétique important, ce qui rend le processus endothermique. Cela est généralement réalisé en chauffant le méthane à des températures supérieures à 1 000 °C (1 832 °F), bien que des catalyseurs puissent parfois réduire cette exigence.
L'absence d'oxygène
L'ensemble du processus doit se dérouler dans un environnement anaérobie (sans oxygène). Si de l'oxygène était présent, le méthane brûlerait, produisant du dioxyde de carbone (CO₂) et de l'eau (H₂O) au lieu de l'hydrogène et du carbone solide souhaités.
Pourquoi la pyrolyse est importante pour la production d'hydrogène
La pyrolyse du méthane suscite une attention considérable en tant que technologie de transition potentielle dans la transition énergétique. Elle offre une proposition de valeur unique par rapport aux autres méthodes établies de production d'hydrogène.
Une voie d'hydrogène "turquoise"
L'hydrogène est souvent codé par couleur en fonction de sa méthode de production. L'hydrogène gris est produit à partir de gaz naturel via le reformage du méthane à la vapeur (SMR), un processus qui émet de grandes quantités de CO₂. L'hydrogène vert est produit par électrolyse à l'aide d'électricité renouvelable, sans émissions.
La pyrolyse du méthane crée ce que l'on appelle l'hydrogène turquoise. Elle utilise une matière première fossile (méthane) mais ne produit pas d'émissions de carbone gazeuses, ce qui la place entre le gris et le vert sur le spectre de l'intensité carbone.
L'avantage clé : pas d'émissions de carbone gazeuses
Le principal avantage de la pyrolyse est que le carbone est capturé directement sous forme solide. Cela évite le besoin de systèmes complexes et coûteux de capture, d'utilisation et de stockage du carbone (CCUS), qui sont nécessaires pour convertir l'hydrogène gris en hydrogène "bleu" à faibles émissions.
Le coproduit de carbone solide
Contrairement à d'autres processus où le CO₂ est un déchet à gérer, le carbone solide issu de la pyrolyse est un coproduit tangible. Sa forme, sa pureté et sa valeur marchande sont essentielles à l'économie globale du processus.
Comprendre les compromis et les défis
Bien que prometteuse, la pyrolyse du méthane n'est pas une solution miracle. Sa viabilité dépend de la résolution de défis techniques et économiques importants.
Apport énergétique élevé
En tant que processus endothermique, la pyrolyse exige un apport important et continu de chaleur à haute température. La source de cette énergie est un facteur critique. Si la chaleur est générée en brûlant plus de gaz naturel, l'empreinte carbone globale du processus augmente, diminuant ses références "à faible émission de carbone". L'utilisation d'électricité renouvelable pour le chauffage par plasma ou résistif est une solution, mais elle ajoute des coûts.
Conception du réacteur et encrassement
La gestion du processus à des températures extrêmes est un défi d'ingénierie majeur. Un problème clé est l'encrassement par le carbone, où le sous-produit de carbone solide se dépose sur les surfaces du réacteur, les catalyseurs et les échangeurs de chaleur, réduisant l'efficacité et nécessitant des arrêts périodiques pour le nettoyage.
La valeur du carbone
La viabilité économique de l'hydrogène turquoise dépend souvent de la capacité à vendre le coproduit de carbone solide. La valeur de ce carbone varie considérablement, allant du noir de carbone de grande valeur utilisé dans les pneus et les pigments au charbon de bois ou à la suie de faible valeur qui peut même avoir un coût d'élimination. La production d'un produit de carbone constant et de haute pureté est un objectif technique primordial.
Faire le bon choix pour votre objectif
Votre évaluation de la technologie de pyrolyse du méthane doit être alignée sur vos objectifs stratégiques spécifiques.
- Si votre objectif principal est de décarboniser l'infrastructure de gaz naturel existante : La pyrolyse offre une voie convaincante pour produire de l'hydrogène sans émissions directes de CO₂, en tirant potentiellement parti des gazoducs existants tout en évitant les coûts d'investissement et les risques géologiques du CCUS.
- Si votre objectif principal est de produire l'hydrogène le plus propre possible : L'hydrogène vert, produit par électrolyse alimentée par des énergies renouvelables dédiées, reste la référence, car il élimine entièrement l'utilisation des combustibles fossiles.
- Si votre objectif principal est la viabilité économique : Le succès d'un projet de pyrolyse est déterminé par trois facteurs : l'accès à du gaz naturel bon marché, une source d'énergie à faible coût et à faible émission de carbone pour la chaleur, et un marché fiable pour le carbone solide de grande valeur produit.
La pyrolyse du méthane représente un outil puissant mais complexe pour la décarbonisation, où la gestion de l'apport énergétique et de la production de carbone est tout aussi importante que la production d'hydrogène elle-même.
Tableau récapitulatif :
| Aspect clé | Description |
|---|---|
| Processus | Décomposition thermique du méthane dans un environnement sans oxygène (>1 000 °C). |
| Produit principal | Gaz d'hydrogène (H₂), classé comme hydrogène 'turquoise'. |
| Sous-produit | Carbone solide (par exemple, noir de carbone), qui peut être vendu ou stocké. |
| Avantage clé | Produit de l'hydrogène à partir de gaz naturel sans émissions directes de CO₂. |
| Défi principal | Apport énergétique élevé et gestion de l'encrassement par le carbone dans les réacteurs. |
Prêt à explorer des solutions de production d'hydrogène pour votre laboratoire ou votre projet pilote ? KINTEK est spécialisé dans les équipements de laboratoire à haute température et les consommables essentiels pour la recherche et le développement de processus tels que la pyrolyse du méthane. Que vous ayez besoin de réacteurs, d'éléments chauffants ou d'outils analytiques, notre expertise peut vous aider à optimiser vos expériences et à faire évoluer votre technologie. Contactez nos experts dès aujourd'hui pour discuter de la manière dont nous pouvons soutenir votre innovation en matière d'énergie propre.
Guide Visuel
Produits associés
- Réacteurs haute pression personnalisables pour des applications scientifiques et industrielles avancées
- Four rotatif électrique pour pyrolyse de biomasse
- Mini réacteur autoclave haute pression SS pour utilisation en laboratoire
- Réacteur Autoclave de Laboratoire Haute Pression pour Synthèse Hydrothermale
- Réacteur Autoclave Haute Pression en Acier Inoxydable pour Laboratoire
Les gens demandent aussi
- Quel est le rôle des réacteurs à haute pression dans l'étude de l'oxydation des alliages ? Des outils essentiels pour la recherche en conditions supercritiques
- Quelle est la fonction d'un réacteur hydrothermique à température constante ? Maîtriser l'activation des cendres volantes de charbon
- Quelle est la contribution d'un réacteur hydrothermique à la construction de pores gradués ? Gabarits de précision pour le TAS
- Comment un réacteur à haute pression démontre-t-il sa valeur dans le vieillissement accéléré ? Prédiction rapide de la durabilité des catalyseurs
- Pourquoi les récipients de réaction de laboratoire scellés sont-ils nécessaires dans la synthèse hydrothermale des zéolithes ? Assurer la pureté et le rendement



















