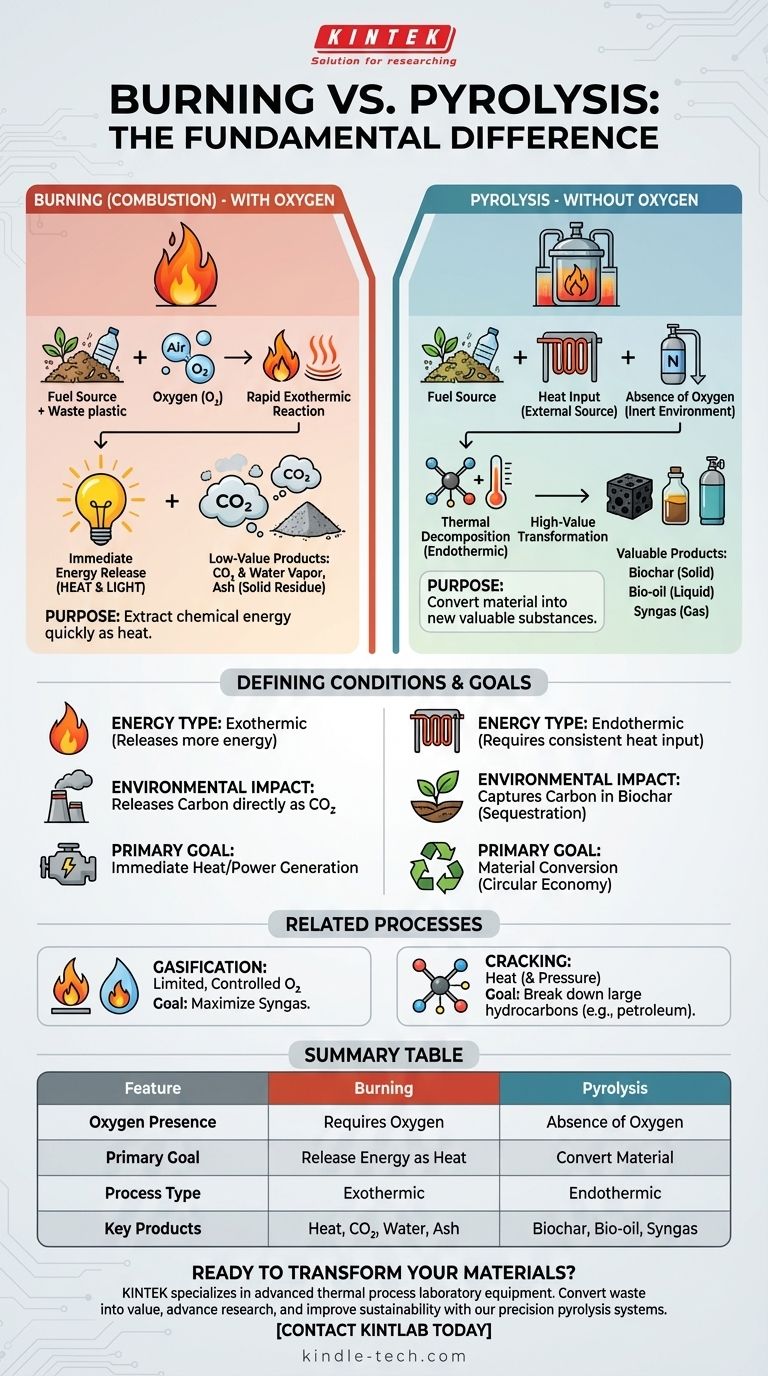
À la base, la différence est l'oxygène. La combustion est une réaction chimique qui utilise l'oxygène pour libérer rapidement de l'énergie d'un matériau sous forme de chaleur et de lumière. La pyrolyse est un processus de décomposition thermique qui utilise la chaleur pour décomposer un matériau en l'absence totale d'oxygène, le transformant en de nouvelles substances précieuses au lieu de simplement le brûler.
La distinction fondamentale est une question d'objectif. La combustion est un processus d'oxydation conçu pour libérer de l'énergie, produisant des cendres et des gaz de faible valeur. La pyrolyse est un processus de décomposition conçu pour convertir le matériau, produisant des solides de haute valeur (biochar), des liquides (bio-huile) et des gaz (syngaz).

Définition des processus fondamentaux
Pour comprendre les implications pratiques, nous devons d'abord définir clairement les conditions et les résultats de chaque processus.
Qu'est-ce que la combustion ?
La combustion est une réaction à haute température entre une source de combustible et un oxydant, presque toujours l'oxygène atmosphérique.
C'est un processus exothermique, ce qui signifie qu'il libère plus d'énergie qu'il n'en consomme, ce que nous ressentons comme une flamme.
Les principaux produits sont généralement le dioxyde de carbone (CO2), la vapeur d'eau et un résidu solide appelé cendre.
Qu'est-ce que la pyrolyse ?
La pyrolyse est la décomposition thermique d'un matériau à haute température dans un environnement inerte ou sans oxygène.
Comme il n'y a pas d'oxygène pour réagir, le matériau ne brûle pas. Au lieu de cela, ses molécules complexes se décomposent en molécules plus petites, souvent plus précieuses.
Ce processus est principalement endothermique, nécessitant une source de chaleur externe constante. Ses produits — le biochar (un solide), le bio-huile (un liquide) et le syngaz (un gaz) — conservent une teneur énergétique élevée.
Comment la pyrolyse diffère des processus connexes
Le terme "pyrolyse" est spécifique et souvent confondu avec d'autres traitements thermiques. Clarifier ces distinctions est essentiel pour comprendre son rôle unique.
Pyrolyse vs. Gazéification
La gazéification implique le chauffage d'un matériau avec une quantité très limitée et contrôlée d'oxygène — pas assez pour une combustion complète.
Elle fonctionne généralement à des températures plus élevées que la pyrolyse (>700°C) avec pour objectif principal de maximiser la production de gaz de synthèse (syngaz), un mélange d'hydrogène et de monoxyde de carbone.
Pyrolyse vs. Craquage
Le craquage est un terme plus large, courant dans l'industrie pétrolière, désignant la décomposition de grandes molécules d'hydrocarbures en molécules plus petites et plus utiles à l'aide de chaleur et souvent de pression.
La pyrolyse peut être considérée comme un type spécifique de craquage thermique, mais elle est le plus souvent appliquée à la biomasse, aux plastiques ou à d'autres déchets, tandis que le "craquage" est plus associé au raffinage du pétrole brut.
Comprendre les compromis et l'objectif
Le choix entre la combustion et la pyrolyse est entièrement dicté par le résultat souhaité. Un processus détruit le matériau pour son énergie, tandis que l'autre le transforme en nouvelles matières premières.
L'objectif de la combustion : Libération immédiate d'énergie
Le seul but de la combustion est d'extraire l'énergie chimique stockée dans un matériau sous forme de chaleur aussi rapidement et complètement que possible.
Cette chaleur peut être utilisée directement pour des processus industriels ou pour générer de l'électricité. Les cendres et les gaz de combustion résultants sont généralement considérés comme des déchets.
L'objectif de la pyrolyse : Transformation des matériaux
Le but de la pyrolyse est de créer de nouveaux produits précieux à partir d'une matière première de faible valeur, comme la biomasse ou les déchets plastiques.
Au lieu d'être libérée sous forme de chaleur, l'énergie et la structure chimique du matériau original sont préservées dans le biochar, le bio-huile et le syngaz. Chacun d'eux peut être raffiné davantage, utilisé comme combustible ou servir de bloc de construction chimique.
L'équation environnementale
La combustion libère directement du carbone dans l'atmosphère sous forme de CO2.
La pyrolyse offre une voie différente. Elle peut capturer le carbone sous la forme solide et stable de biochar, qui peut être utilisé pour l'amendement du sol ou d'autres applications, le séquestrant efficacement. Cela en fait une technologie clé dans les stratégies d'économie circulaire et de capture du carbone.
Faire le bon choix pour votre objectif
Le choix du processus thermique correct dépend entièrement de ce que vous avez l'intention d'accomplir avec la matière première.
- Si votre objectif principal est la production immédiate de chaleur ou d'électricité sur site : La combustion est la méthode la plus directe et la plus établie pour libérer de l'énergie.
- Si votre objectif principal est de créer des produits à valeur ajoutée à partir de déchets ou de biomasse : La pyrolyse est le meilleur choix pour convertir la matière première en de nouveaux matériaux stockables, transportables et précieux.
- Si votre objectif principal est de produire un combustible gazeux pour des moteurs spécialisés ou la synthèse chimique : La gazéification est le processus optimisé pour maximiser le rendement en syngaz.
En fin de compte, choisir le bon processus thermique, c'est décider si vous voulez libérer l'énergie d'un matériau maintenant ou convertir sa structure en de nouvelles formes de valeur pour l'avenir.
Tableau récapitulatif :
| Caractéristique | Combustion | Pyrolyse |
|---|---|---|
| Présence d'oxygène | Nécessite de l'oxygène | Absence d'oxygène |
| Objectif principal | Libérer de l'énergie sous forme de chaleur | Convertir le matériau en nouveaux produits |
| Type de processus | Exothermique (libère de la chaleur) | Endothermique (nécessite un apport de chaleur) |
| Produits clés | Chaleur, CO₂, vapeur d'eau, cendres | Biochar (solide), bio-huile (liquide), syngaz |
Prêt à transformer vos déchets en ressources précieuses ?
KINTEK est spécialisé dans les équipements de laboratoire avancés pour les processus thermiques comme la pyrolyse. Que vous recherchiez la conversion de biomasse, le développement de nouveaux matériaux à partir de plastiques usagés ou l'optimisation des capacités de votre laboratoire, nos solutions sont conçues pour la précision, l'efficacité et la fiabilité.
Nous aidons nos clients à :
- Convertir les déchets en valeur : Produire du biochar, du bio-huile et du syngaz de haute valeur.
- Faire progresser la recherche : Avec des systèmes de pyrolyse précis et contrôlés.
- Améliorer la durabilité : Mettre en œuvre des stratégies d'économie circulaire et de capture du carbone dans votre laboratoire.
Discutons de la manière dont nos équipements de pyrolyse peuvent répondre à vos besoins spécifiques en laboratoire. Contactez KINTLAB dès aujourd'hui pour une consultation !
Guide Visuel
Produits associés
- Four rotatif continu scellé sous vide Four rotatif
- Four à tube de laboratoire à haute température de 1400℃ avec tube en alumine
- Four de laboratoire tubulaire vertical
- Four à moufle haute température pour déliantage et pré-frittage en laboratoire
- Four tubulaire de traitement thermique rapide (RTP) de laboratoire
Les gens demandent aussi
- Quelle est la différence entre la pyrolyse, la combustion et la gazéification ? Un guide des technologies de conversion thermique
- Quelle température est nécessaire pour la pyrolyse des déchets ? Un guide pour optimiser votre processus de valorisation des déchets
- Comment les fours de réaction à haute température contrôlent-ils les MMC in-situ ? Maîtriser la précision des matériaux et l'intégrité structurelle
- Pourquoi des températures élevées sont-elles requises lors du frittage des aciers inoxydables ? Obtenez des résultats purs et de haute densité
- Quelle est la plage de température de la pyrolyse ? Maîtriser le contrôle de la température pour des rendements optimaux en bioproduits



















