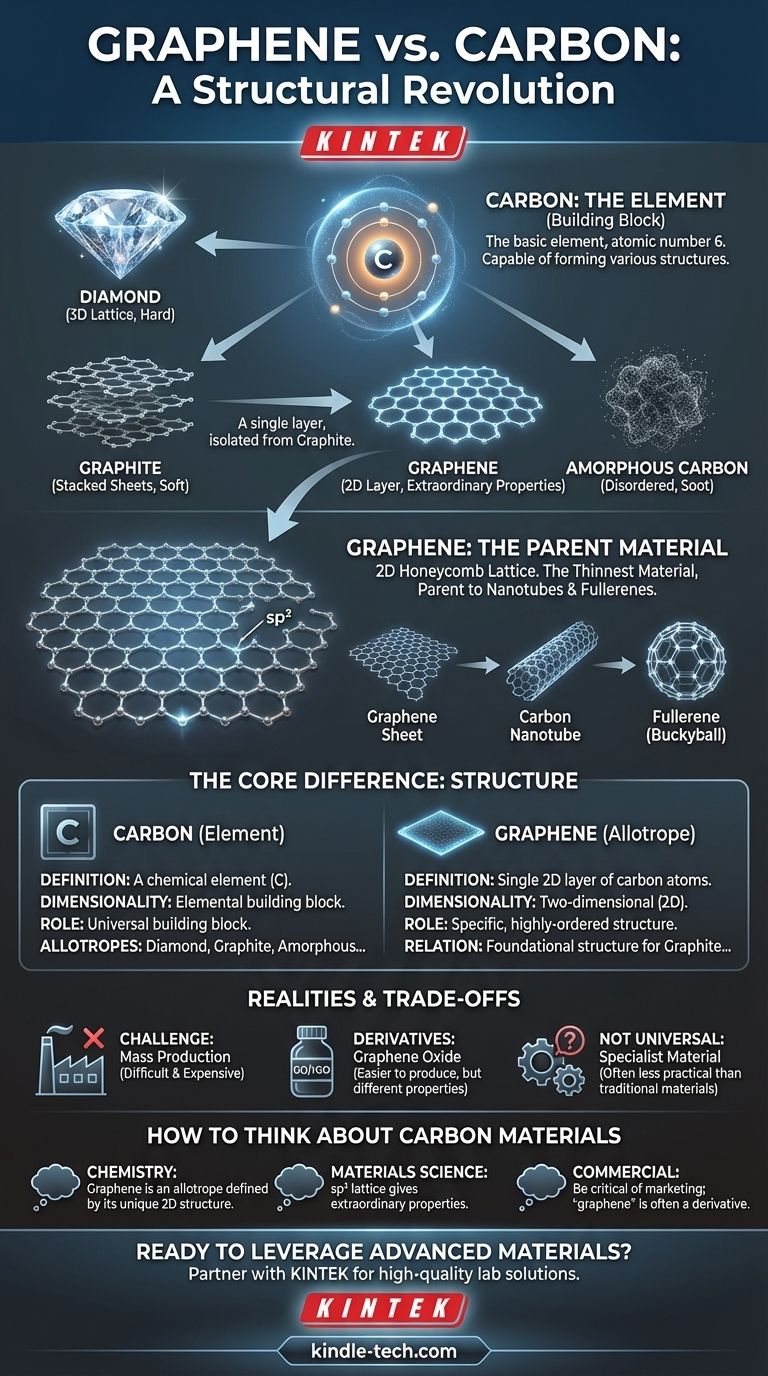
La différence fondamentale n'est pas une question de substance, mais de structure. Le graphène n'est pas un matériau différent du carbone ; c'est une forme spécifique et bidimensionnelle de l'élément carbone. Alors que le carbone est l'élément de base, le graphène est une couche unique, d'un atome d'épaisseur, d'atomes de carbone disposés dans un réseau en nid d'abeille précis, et cet arrangement unique est la source de toutes ses propriétés extraordinaires.
La distinction essentielle à retenir est que le "carbone" est l'élément — le bloc de construction — tandis que le "graphène" est une structure spécifique, hautement ordonnée, construite exclusivement à partir de ces blocs. Pensez-y comme le diamant et le graphite : tous deux sont du carbone pur, mais leurs arrangements atomiques différents leur confèrent des propriétés très différentes.

De l'élément à l'allotrope : Le fondement du carbone
Pour comprendre le rôle du graphène, nous devons d'abord saisir la polyvalence de son élément parent, le carbone. Ce contexte est essentiel pour apprécier pourquoi un simple changement structurel peut créer un matériau révolutionnaire.
Le carbone : Le bloc de construction universel
Le carbone est un élément (numéro atomique 6) que l'on trouve dans le tableau périodique. Sa caractéristique principale est sa capacité à former des liaisons covalentes fortes avec lui-même et de nombreux autres éléments, créant un grand nombre de composés.
Sous sa forme élémentaire, le carbone peut exister sous plusieurs configurations structurelles différentes.
Le concept d'allotropes
Ces différentes formes structurelles d'un même élément sont appelées allotropes. Les atomes sont identiques, mais leur arrangement dans l'espace est différent, ce qui conduit à des propriétés physiques et chimiques radicalement différentes.
L'exemple classique est la relation entre le graphite mou et gris utilisé dans les crayons et le diamant dur et transparent utilisé en joaillerie. Tous deux sont du carbone pur, mais leurs propriétés divergent entièrement en raison de leur structure atomique.
Allotropes de carbone courants
Le graphène n'est qu'un des nombreux allotropes importants du carbone. Les principaux incluent :
- Diamant : Les atomes de carbone sont arrangés dans un réseau tétraédrique rigide et tridimensionnel. Cela le rend incroyablement dur.
- Graphite : Les atomes de carbone sont arrangés en feuillets d'un réseau hexagonal, qui sont empilés les uns sur les autres. Ces couches peuvent glisser facilement, rendant le graphite mou.
- Graphène : Une seule couche isolée du réseau hexagonal qui compose le graphite.
- Carbone amorphe : Une forme, comme la suie ou le charbon de bois, où les atomes de carbone n'ont pas d'ordre cristallin à longue portée.
Qu'est-ce qui fait du graphène une forme unique de carbone ?
La renommée du graphène vient du fait qu'il est l'expression la plus pure du potentiel bidimensionnel du carbone. C'est la structure fondamentale pour d'autres allotropes.
Un véritable matériau bidimensionnel
La caractéristique principale du graphène est qu'il s'agit d'une couche atomique unique. Avec seulement un atome d'épaisseur, c'est le matériau le plus fin jamais créé, un véritable plan d'atomes en 2D.
Le réseau en nid d'abeille
Les atomes de carbone dans le graphène sont liés par des liaisons sp², formant un motif hexagonal parfaitement répétitif, très similaire à un nid d'abeille ou à un grillage. Cette structure plate et fortement liée est la source de sa stabilité et de sa force remarquables.
Le parent d'autres matériaux
Comprendre le graphène clarifie sa relation avec d'autres formes de carbone. On peut considérer le graphite comme un empilement d'innombrables feuilles de graphène. De plus, on peut conceptuellement rouler une feuille de graphène en un tube pour former un nanotube de carbone ou l'envelopper en une sphère pour former un fullerène (buckyball).
Comprendre les compromis et les réalités pratiques
Bien que les propriétés du graphène soient extraordinaires, son application dans le monde réel est limitée par d'importants défis pratiques. Reconnaître ces limitations est essentiel pour une compréhension objective.
Le défi de la production de masse
Produire de grandes feuilles de graphène vierge sans défaut est extrêmement difficile et coûteux. La célèbre "méthode du ruban adhésif" utilisée pour sa découverte (détacher des couches de graphite) n'est pas évolutive pour un usage industriel.
"Graphène" vs. Dérivés du graphène
De nombreux produits commercialisés comme contenant du "graphène" utilisent en fait des matériaux apparentés comme l'oxyde de graphène (GO) ou l'oxyde de graphène réduit (rGO). Ceux-ci sont plus faciles et moins chers à produire en vrac, mais ont des propriétés électriques et mécaniques différentes, et souvent inférieures, par rapport au graphène pur.
Pas une solution universelle
Le graphène est un matériau spécialisé. Bien qu'il soit plus résistant que l'acier et plus conducteur que le cuivre, son coût et les difficultés d'intégration font que les matériaux traditionnels restent plus pratiques et plus rentables pour la grande majorité des applications.
Comment penser aux matériaux carbonés
Votre perspective sur la relation carbone-graphène dépend de votre objectif. Utilisez ces points pour encadrer votre réflexion.
- Si votre objectif principal est la chimie fondamentale : Rappelez-vous que le graphène est un allotrope de l'élément carbone, défini par sa structure unique en nid d'abeille 2D.
- Si votre objectif principal est la science des matériaux : Concentrez-vous sur la façon dont le réseau à liaisons
sp²du graphène donne naissance à des propriétés extraordinaires — résistance, conductivité et légèreté — qui sont fondamentalement différentes des allotropes 3D comme le diamant. - Si votre objectif principal est les produits commerciaux : Soyez critique envers les allégations marketing et comprenez que le "graphène" utilisé est souvent un dérivé, où le défi réside dans la réalisation d'une production rentable à grande échelle.
En fin de compte, reconnaître la différence entre le carbone en tant qu'élément et le graphène en tant que structure est la clé pour comprendre une nouvelle classe de matériaux conçus au niveau atomique.
Tableau récapitulatif :
| Caractéristique | Carbone (Élément) | Graphène (Allotrope) |
|---|---|---|
| Définition | Un élément chimique (C) | Une seule couche d'atomes de carbone dans un réseau en nid d'abeille 2D |
| Dimensionalité | S/O (Bloc de construction élémentaire) | Bidimensionnel (2D) |
| Allotropes clés | Diamant, Graphite, Carbone amorphe | La structure fondamentale du Graphite, des Nanotubes de carbone |
| Distinction principale | Le bloc de construction universel | Une structure spécifique, hautement ordonnée, faite d'atomes de carbone |
Prêt à exploiter les matériaux avancés dans votre recherche ?
Comprendre les nuances de matériaux comme le graphène est essentiel à l'innovation. Chez KINTEK, nous sommes spécialisés dans la fourniture d'équipements de laboratoire et de consommables de haute qualité dont vous avez besoin pour repousser les limites de la science des matériaux. Que vous travailliez avec des allotropes de carbone ou d'autres matériaux avancés, nos produits garantissent précision, fiabilité et découverte.
Laissez KINTEK être votre partenaire de recherche. Contactez nos experts dès aujourd'hui pour trouver les solutions parfaites pour les défis uniques de votre laboratoire.
Guide Visuel
Produits associés
- Mélangeur Vortex de laboratoire Agitateur orbital Mélangeur rotatif oscillant multifonctionnel
- Broyeur hybride de laboratoire pour tissus
- Homogénéisateur à cisaillement élevé pour applications pharmaceutiques et cosmétiques
- Fabricant personnalisé de pièces en PTFE Téflon pour tamis en maille F4 en PTFE
- Presse Thermique Automatique de Laboratoire
Les gens demandent aussi
- Quel type de méthode est la pulvérisation cathodique magnétron ? Une technique de revêtement PVD à haute efficacité
- Quels matériaux peuvent être déposés par CVD ? Découvrez le spectre complet, des semi-conducteurs aux céramiques
- Quel catalyseur est utilisé pour la croissance des nanotubes de carbone par dépôt chimique en phase vapeur ? Métaux clés pour une synthèse contrôlée
- Quelles sont les méthodes de caractérisation des couches minces ? Choisissez les bons outils pour votre application
- Pourquoi la production de masse de nanotubes de carbone est-elle un défi aujourd'hui ? Le dilemme de l'échelle, de la qualité et du coût
- Quelles sont les étapes du processus de pulvérisation cathodique ? Maîtrisez le dépôt de couches minces pour votre laboratoire
- Quelle est la structure des nanotubes de carbone à paroi simple ? Comprendre la chiralité pour les propriétés métalliques ou semi-conductrices
- Quelle est l'importance de la pulvérisation cathodique ? Obtenez des films minces supérieurs pour la fabrication de haute technologie



















