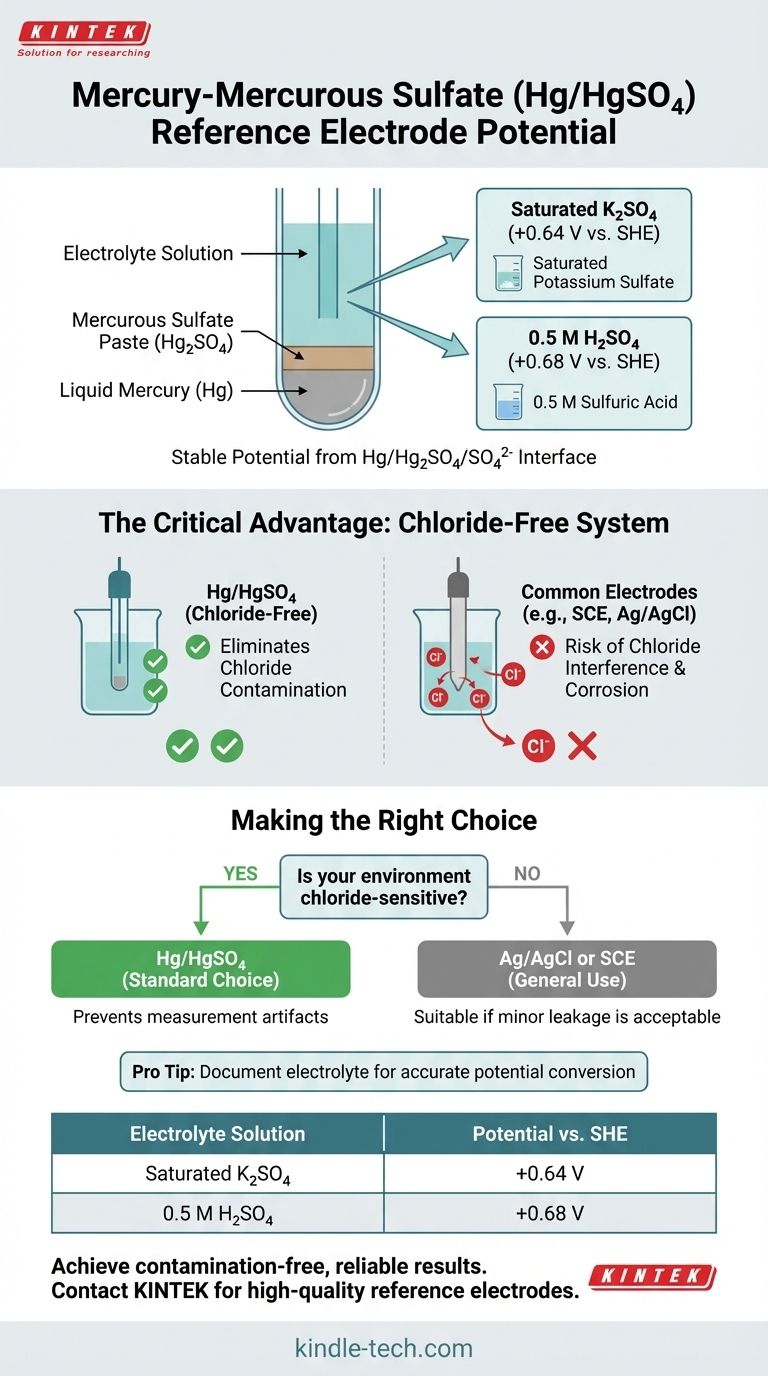
Le potentiel accepté d'une électrode de référence mercure-sulfate mercureux (Hg/HgSO4) est généralement de +0,64 V par rapport à l'électrode normale à hydrogène (SHE) lors de l'utilisation d'un électrolyte de sulfate de potassium saturé (K2SO4). Cette valeur change légèrement pour atteindre +0,68 V vs. SHE lorsqu'un électrolyte d'acide sulfurique (H2SO4) 0,5 M est utilisé.
L'électrode Hg/HgSO4 est une électrode de référence spécialisée, très stable, appréciée pour une raison essentielle : elle fonctionne sans ions chlorure. Cela en fait le choix indispensable pour les expériences électrochimiques où la contamination par les chlorures interférerait avec les résultats ou endommagerait le système.

Qu'est-ce qu'une électrode mercure-sulfate mercureux ?
Les composants principaux
Une électrode mercure-sulfate mercureux se compose d'une flaque de mercure (Hg) liquide en contact direct avec une pâte de sulfate mercureux (Hg₂SO₄) solide.
Le rôle de l'électrolyte
Cette pâte de mercure et de sulfate est immergée dans une solution aqueuse contenant une forte concentration d'ions sulfate. Il s'agit le plus souvent d'une solution de sulfate de potassium saturé (K₂SO₄) ou d'une solution d'acide sulfurique (H₂SO₄) 0,5 M.
Comment elle fournit une référence stable
L'interface entre le mercure, son sel peu soluble (Hg₂SO₄) et les ions sulfate dans l'électrolyte crée une demi-réaction électrochimique stable et reproductible. Cet équilibre génère un potentiel constant, qui sert de référence fiable par rapport à laquelle le potentiel d'une électrode de travail est mesuré.
Comprendre son potentiel par rapport à la SHE
Potentiel dans le sulfate de potassium (K₂SO₄)
Lors de l'utilisation d'une solution de remplissage de sulfate de potassium saturé, le potentiel standard de l'électrode Hg/HgSO₄ est de +0,64 V par rapport à l'électrode normale à hydrogène (SHE).
Potentiel dans l'acide sulfurique (H₂SO₄)
Dans les environnements acides, une solution de remplissage d'acide sulfurique 0,5 M est souvent utilisée. Cela décale légèrement le potentiel à +0,68 V vs. SHE. Le changement est dû à l'activité différente des ions sulfate dans les deux solutions électrolytiques.
L'avantage critique : un système sans chlorure
Le problème avec les électrodes courantes
Les électrodes de référence les plus utilisées, telles que l'électrode au calomel saturée (ECS) et l'électrode argent/chlorure d'argent (Ag/AgCl), sont remplies de solutions concentrées de chlorure de potassium (KCl).
Pourquoi les fuites de chlorure sont une préoccupation
Pendant une expérience, une quantité minuscule de cette solution de remplissage riche en chlorure peut s'échapper de la jonction de l'électrode et pénétrer dans votre solution de test. C'est un problème important dans les systèmes où les ions chlorure peuvent interférer avec la réaction, empoisonner un catalyseur ou corroder les composants en acier inoxydable.
La solution Hg/HgSO₄
L'électrode Hg/HgSO₄ a été développée spécifiquement pour résoudre ce problème. En utilisant un électrolyte à base de sulfate au lieu d'un électrolyte à base de chlorure, elle élimine complètement le risque de contamination par les chlorures, garantissant l'intégrité de vos mesures dans les systèmes sensibles.
Faire le bon choix pour votre objectif
- Si votre objectif principal est de travailler dans des environnements sensibles aux chlorures : L'électrode Hg/HgSO₄ est le choix correct et standard pour prévenir les artefacts de mesure et les dommages au système.
- Si votre objectif principal est l'électrochimie aqueuse générale : Une électrode Ag/AgCl ou ECS plus courante et souvent moins chère est parfaitement adaptée, tant qu'une fuite mineure de chlorure est acceptable.
- Si votre objectif principal est de convertir des potentiels : Documentez toujours l'électrolyte spécifique utilisé dans votre électrode Hg/HgSO₄ (par exemple, K₂SO₄ saturé ou H₂SO₄ 0,5 M) pour appliquer le facteur de conversion correct à l'échelle SHE.
Le choix de l'électrode de référence appropriée est fondamental pour obtenir des données électrochimiques précises et fiables.
Tableau récapitulatif :
| Solution électrolytique | Potentiel vs. Électrode Normale à Hydrogène (SHE) |
|---|---|
| Sulfate de potassium saturé (K₂SO₄) | +0,64 V |
| Acide sulfurique 0,5 M (H₂SO₄) | +0,68 V |
Obtenez des résultats fiables et sans contamination dans vos expériences électrochimiques sensibles. L'électrode de référence Hg/HgSO4 est le choix définitif pour les applications où les ions chlorure interféreraient avec votre réaction, empoisonneraient un catalyseur ou endommageraient votre système. KINTEK est spécialisé dans la fourniture d'équipements de laboratoire et de consommables de haute qualité, y compris des électrodes de référence fiables, pour répondre aux besoins précis de votre laboratoire. Assurez l'intégrité de vos données — contactez nos experts dès aujourd'hui pour trouver l'électrode de référence parfaite pour votre recherche.
Guide Visuel
Produits associés
- Électrode de référence au calomel, chlorure d'argent, sulfate de mercure pour usage en laboratoire
- Électrode à disque d'or
- Électrode à disque de platine rotatif pour applications électrochimiques
- Électrode électrochimique en graphite, tige et plaque de graphite
- Électrode électrochimique à disque métallique
Les gens demandent aussi
- Quels sont les avantages techniques du RRDE pour les études électrochimiques ? Détection des intermédiaires en temps réel
- Pourquoi le platine est-il utilisé dans les électrodes épidurales ? Biocompatibilité supérieure et efficacité électrique
- De quel matériau est constituée une électrode à disque de platine ? Le guide définitif des matériaux d'électrode
- Quelles procédures opérationnelles doivent être suivies pour une électrode en titane pendant une expérience ? Assurer l'intégrité du revêtement et des résultats reproductibles
- Quel est le principe de fonctionnement d'une électrode à disque d'or dans un système électrochimique ? Atteignez la précision avec une interface stable
- Quelle est la fonction des électrodes enroulées en spirale dans les eaux usées à faible concentration ? Maximisez l'efficacité de votre récupération de métaux
- Comment choisir la poudre d'alumine pour le polissage d'une électrode à disque, et quelle est la procédure pour éliminer les rayures ? Obtenez une finition miroir parfaite
- Pourquoi une tige de carbone est-elle généralement sélectionnée comme électrode de contre-électrode pour les électrolytes acides ? Assurer une grande inertie chimique



















