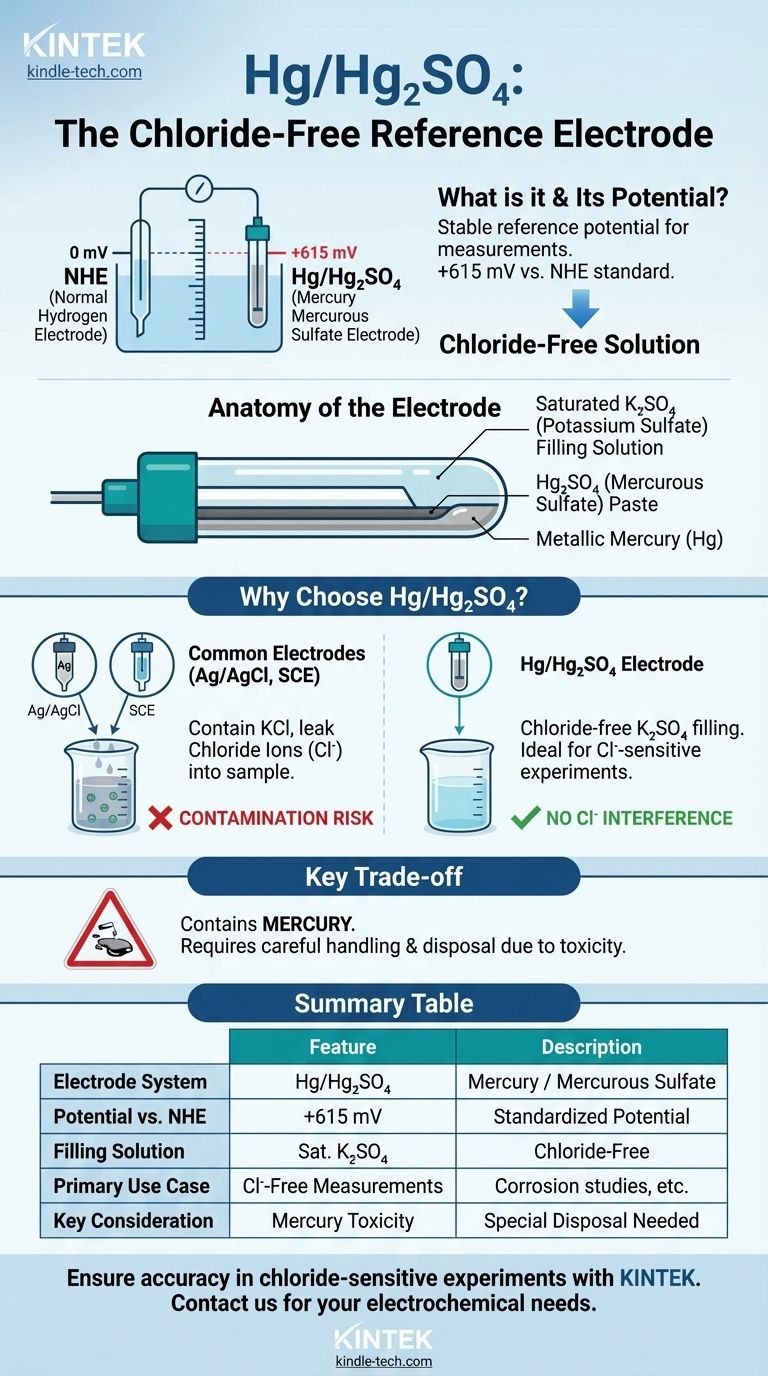
Techniquement, le système mercure/sulfate mercureux (Hg/Hg₂SO₄) est lui-même une électrode de référence. Son objectif est de fournir un potentiel électrochimique stable et connu par rapport auquel d'autres potentiels peuvent être mesurés. Le standard auquel il est rapporté est l'Électrode Normale à Hydrogène (ENH), par rapport à laquelle l'électrode Hg/Hg₂SO₄ présente un potentiel de +615 mV.
L'électrode Hg/Hg₂SO₄ est une électrode de référence spécialisée, exempte de chlorure. Elle est utilisée dans les applications électrochimiques où la contamination par des ions chlorure provenant d'électrodes plus courantes, telles que Ag/AgCl ou Calomel, interférerait avec la mesure ou endommagerait l'échantillon.

Le Rôle d'une Électrode de Référence
Le Besoin d'une Base Stable
En électrochimie, nous ne pouvons mesurer que la différence de potentiel entre deux points, et non un potentiel absolu. Une électrode de référence agit comme l'un de ces points, fournissant un potentiel constant et stable.
Cela permet d'attribuer avec confiance tout changement de tension mesurée à la réaction se produisant à l'autre électrode, connue sous le nom d'électrode de travail.
Le Standard Universel : ENH
L'ensemble de l'échelle électrochimique est standardisé par rapport à l'Électrode Normale à Hydrogène (ENH), à laquelle est attribué par définition un potentiel de 0,000 volt. Tous les autres potentiels d'électrodes de référence, y compris celui de Hg/Hg₂SO₄, sont rapportés par rapport à ce standard universel.
Anatomie de l'Électrode Hg/Hg₂SO₄
Composants de Base
L'électrode se compose de mercure métallique (Hg) en contact direct avec une pâte de sulfate mercureux (Hg₂SO₄). Cet équilibre fournit le potentiel stable.
La Solution de Remplissage Sans Chlorure
Sa caractéristique déterminante est sa solution de remplissage, qui est généralement du sulfate de potassium (K₂SO₄) saturé. Ceci est fondamentalement différent de la solution de chlorure de potassium (KCl) utilisée dans les électrodes de référence plus courantes.
Son Potentiel Standard
Le potentiel établi pour l'électrode mercure/sulfate mercureux est de +0,615 V (ou +615 mV) par rapport à l'ENH. Cette valeur est essentielle pour convertir vos mesures expérimentales en une échelle standardisée.
Pourquoi Choisir Hg/Hg₂SO₄ ?
Le Problème de la Contamination par les Chlorures
Les deux électrodes de référence les plus courantes sont l'argent/chlorure d'argent (Ag/AgCl) et l'électrode au calomel saturée (ECS). Toutes deux reposent sur une solution de remplissage de chlorure de potassium (KCl) saturé.
Une petite quantité de cette solution fuit inévitablement de la pointe de l'électrode dans l'échantillon testé. Pour de nombreuses expériences, ce n'est pas un problème.
Quand Utiliser une Référence au Sulfate
Cependant, si votre expérience est sensible aux ions chlorure (Cl⁻), cette fuite peut invalider vos résultats. L'électrode Hg/Hg₂SO₄ est la solution principale pour ces applications « sans chlorure ».
Ceci est particulièrement critique dans des domaines tels que les études de corrosion, où le chlorure est un agent de piqûre connu, ou dans des solutions où les ions chlorure pourraient précipiter avec d'autres ions de votre échantillon.
Comprendre les Compromis
Toxicité et Élimination
Comme l'électrode au calomel (ECS), l'électrode Hg/Hg₂SO₄ contient du mercure. Cela pose d'importants défis de toxicité et d'élimination environnementale, la rendant inappropriée pour les applications dans l'alimentation, les boissons ou certaines études environnementales.
Popularité Moindre
Comparée à l'électrode Ag/AgCl presque omniprésente, la Hg/Hg₂SO₄ est un équipement plus spécialisé et moins courant.
Faire le Bon Choix pour Votre Expérience
Votre choix d'électrode de référence est essentiel pour garantir l'exactitude et l'intégrité de vos données.
- Si votre objectif principal est l'électrochimie aqueuse générale : L'électrode Ag/AgCl est le choix le plus courant, le plus robuste et le plus pratique pour la plupart des applications.
- Si votre expérience est sensible aux ions chlorure ou implique des ions argent : L'électrode Hg/Hg₂SO₄ est l'alternative standard de l'industrie pour prévenir la contamination par les chlorures.
- Si vous devez éviter à la fois le mercure et le chlorure : Vous devrez peut-être explorer des électrodes encore plus spécialisées, telles que l'électrode cuivre/sulfate de cuivre (Cu/CuSO₄), en fonction de votre système chimique spécifique.
En fin de compte, la meilleure électrode de référence est celle qui fournit un potentiel stable sans interférer avec la chimie que vous avez l'intention d'étudier.
Tableau Récapitulatif :
| Caractéristique Clé | Description |
|---|---|
| Système d'Électrode | Mercure / Sulfate Mercureux (Hg/Hg₂SO₄) |
| Potentiel vs ENH | +615 mV |
| Solution de Remplissage | Sulfate de Potassium Saturé (K₂SO₄) |
| Cas d'Utilisation Principal | Mesures électrochimiques sans chlorure |
| Avantage Principal | Prévient la contamination par les ions chlorure provenant d'électrodes courantes |
| Considération Clé | Contient du mercure ; nécessite une manipulation et une élimination prudentes |
Assurez la précision de vos expériences sensibles aux chlorures avec le bon équipement.
Choisir la bonne électrode de référence est essentiel pour obtenir des résultats valides. L'électrode Hg/Hg₂SO₄ est indispensable pour les applications dans les études de corrosion et autres scénarios où la contamination par les chlorures doit être évitée.
KINTEK se spécialise dans l'équipement et les consommables de laboratoire, répondant à tous vos besoins de laboratoire. Nos experts peuvent vous aider à choisir l'électrode de référence parfaite pour votre installation électrochimique spécifique.
Contactez-nous dès aujourd'hui via notre [#ContactForm] pour discuter de votre application et trouver la solution idéale pour votre recherche.
Guide Visuel
Produits associés
- Électrode de référence au calomel, chlorure d'argent, sulfate de mercure pour usage en laboratoire
- Électrode à disque de platine rotatif pour applications électrochimiques
- Électrode électrochimique à disque métallique
- Électrode à disque d'or
- Électrode de référence au sulfate de cuivre pour usage en laboratoire
Les gens demandent aussi
- Pourquoi un fil de platine est-il couramment utilisé comme électrode auxiliaire dans la recherche sur la corrosion des céramiques d'alumine ? Pureté des données
- Quels sont les avantages de l'utilisation d'une sonde Luggin refroidie par eau pour connecter une électrode de référence dans des tests de corrosion à haute température ?
- Quelle est la fonction d'une électrode auxiliaire en platine ? Obtenez la précision dans les tests électrochimiques à haute contrainte
- Quelle est la porosité d'une feuille de carbone vitreux RVC ? Comprendre la différence critique entre les PPI et la porosité
- Quels sont les rôles des électrodes de contre-platine et de référence Ag/AgCl ? Maîtrisez la précision des tests électrochimiques
- Quel est le but du PTFE dans les électrodes à diffusion de gaz ? Optimiser la structure des pores et prévenir l'inondation de l'électrode
- De quel matériau est constituée une électrode à disque de platine ? Le guide définitif des matériaux d'électrode
- Quelles précautions doivent être prises pour éviter les dommages mécaniques à une électrode en plaque d'or ? Protégez l'intégrité de vos données



















