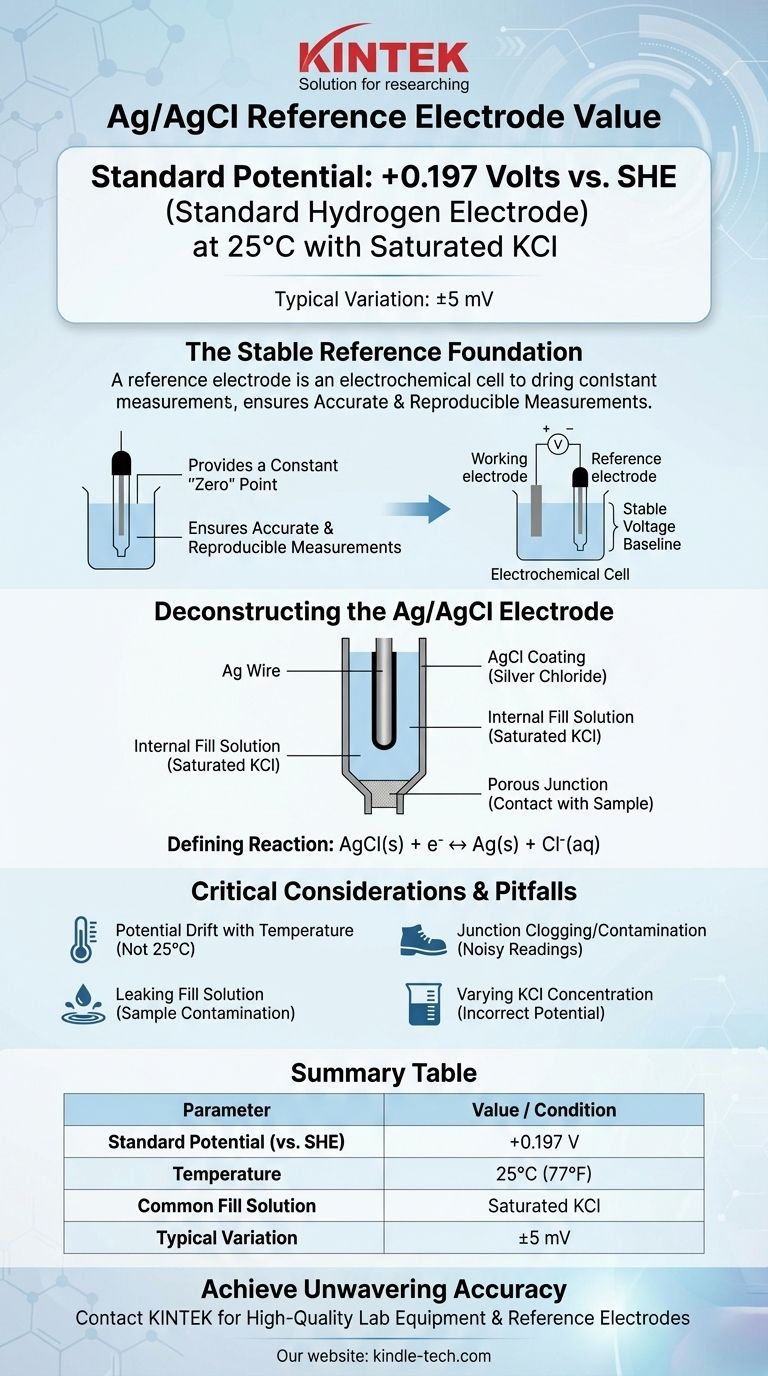
Dans sa configuration la plus courante, l'électrode de référence argent/chlorure d'argent (Ag/AgCl) présente un potentiel de +0,197 Volt par rapport à l'Électrode Standard à Hydrogène (ESH) à 25°C. Cette valeur suppose que l'électrode utilise une solution de remplissage de chlorure de potassium (KCl) saturé. Des variations mineures, souvent citées comme +199 mV (±5mV), sont courantes en raison de légères différences dans la préparation et les conditions.
La fonction principale d'une électrode de référence est de fournir une base de tension stable et inébranlable. Comprendre que le potentiel de l'électrode Ag/AgCl est défini par un équilibre chimique spécifique, et qu'il est sensible à la concentration en chlorure et à la température, est la clé pour l'utiliser pour des mesures précises et reproductibles.

Le rôle d'une référence stable
Établir un point zéro
Toutes les mesures de tension sont intrinsèquement une différence de potentiel entre deux points. En électrochimie, vous ne pouvez pas mesurer le potentiel absolu d'une seule électrode de travail.
Une électrode de référence fournit un potentiel constant et connu qui sert de point « zéro » stable. Tous les autres potentiels de votre cellule électrochimique sont alors mesurés par rapport à cette référence inébranlable.
Comment elle assure la stabilité
Une électrode de référence idéale est décrite comme « bien équilibrée » (well-poised). Cela signifie que son potentiel est régi par une réaction chimique rapide et réversible qui n'est pas significativement perturbée par la minuscule quantité de courant qui circule pendant la mesure.
Pour l'électrode Ag/AgCl, cette stabilité provient de l'équilibre entre le chlorure d'argent solide et les ions argent et chlorure.
Décortiquer l'électrode Ag/AgCl
Les composants de base
Une électrode Ag/AgCl typique se compose d'un fil d'argent (Ag) qui a été recouvert d'une couche de chlorure d'argent (AgCl) solide.
Cet assemblage entier est immergé dans une solution de remplissage interne qui contient une concentration connue et fixe d'ions chlorure (Cl⁻), le plus souvent du chlorure de potassium (KCl). Une jonction poreuse, souvent en céramique ou en coton, permet le contact électrique avec la solution échantillon.
La réaction électrochimique définissante
Le potentiel de l'électrode est établi par une réaction de demi-cellule simple et réversible :
AgCl(s) + e⁻ ↔ Ag(s) + Cl⁻(aq)
Le potentiel de cet équilibre dépend directement de l'activité (effectivement, la concentration) des ions chlorure dans la solution de remplissage.
Pourquoi la solution de remplissage est critique
Étant donné que le potentiel dépend de la concentration en chlorure, sa valeur doit être fixe et connue.
Le KCl saturé est le choix le plus courant car il est facile à préparer et à maintenir. Tant que des cristaux de KCl solides sont présents, la solution reste saturée, assurant une activité constante du chlorure et donc un potentiel stable de +0,197 V.
D'autres concentrations, telles que 3M ou 1M de KCl, sont également utilisées et entraîneront des potentiels de référence différents.
Comprendre les compromis et les pièges
Dérive du potentiel avec la température
Le potentiel standard de +0,197 V n'est valable qu'à 25°C (77°F). Le potentiel de l'électrode changera de manière prévisible avec la température. Pour un travail de haute précision, cette dépendance à la température doit être prise en compte ou contrôlée.
Bouchage et contamination de la jonction
La jonction poreuse est le point de défaillance le plus courant. Si elle se bouche avec le matériau de l'échantillon ou si l'électrolyte interne cristallise à l'intérieur, la connexion électrique est rompue, entraînant des lectures bruitées ou complètement instables.
Fuite de la solution de remplissage
La solution de remplissage interne fuit lentement par la jonction par conception. Si votre échantillon est sensible aux ions chlorure ou potassium, cette fuite peut provoquer une contamination ou des réactions secondaires indésirables, interférant avec votre mesure. Dans ces cas, une électrode à double jonction avec un électrolyte externe différent peut être nécessaire.
Hypothèse d'un KCl saturé
Ne supposez jamais que votre électrode Ag/AgCl utilise une solution de KCl saturée. Vérifiez toujours la concentration de la solution de remplissage, car utiliser le mauvais potentiel de référence dans vos calculs est une source fondamentale d'erreur. Une électrode avec 3M de KCl, par exemple, a un potentiel plus proche de +0,210 V vs. ESH.
Faire le bon choix pour votre objectif
Pour garantir la validité de vos mesures, vous devez considérer votre électrode de référence comme l'instrument critique qu'elle est.
- Si votre objectif principal est l'analyse de routine (par exemple, la mesure du pH) : Utilisez une électrode scellée commerciale, stockez-la correctement dans sa solution de stockage désignée pour maintenir la jonction humide, et remplacez-la lorsque les lectures deviennent instables.
- Si votre objectif principal est la recherche de haute précision (par exemple, les études de corrosion) : Signalez toujours l'électrode de référence spécifique utilisée (par exemple, Ag/AgCl, KCl sat.) avec vos données, surveillez la dérive et envisagez de la calibrer par rapport à un standard fraîchement préparé.
- Si votre objectif principal est d'éviter la contamination de l'échantillon : Sélectionnez une électrode à double jonction ou une électrode avec une solution de remplissage chimiquement compatible avec votre échantillon pour éviter la précipitation ou l'interférence au niveau de la jonction liquide.
Une électrode de référence fiable est le fondement de toute mesure électrochimique précise.
Tableau récapitulatif :
| Paramètre | Valeur / Condition |
|---|---|
| Potentiel Standard (vs. ESH) | +0,197 V |
| Température | 25°C (77°F) |
| Solution de remplissage courante | KCl saturé |
| Variation typique | ±5 mV |
Atteignez une précision inébranlable dans votre laboratoire
Vos mesures électrochimiques ne sont fiables que dans la mesure où l'est votre électrode de référence. KINTEK est spécialisé dans les équipements et consommables de laboratoire de haute qualité, fournissant les électrodes de référence Ag/AgCl précises et stables dont votre laboratoire a besoin pour des résultats reproductibles.
Laissez nos experts vous aider à choisir l'électrode de référence parfaite pour votre application, qu'il s'agisse d'analyses de routine ou de recherche de haute précision.
Contactez KINTEK dès aujourd'hui pour vous assurer que vos mesures reposent sur une base solide.
Guide Visuel
Produits associés
- Électrode à disque de platine rotatif pour applications électrochimiques
- Électrode de référence au sulfate de cuivre pour usage en laboratoire
- Électrode à disque d'or
- Électrode auxiliaire en platine pour usage en laboratoire
- Électrode à disque rotatif (disque-anneau) RRDE / Compatible avec PINE, ALS japonais, Metrohm suisse carbone vitreux platine
Les gens demandent aussi
- Quelle est une application courante pour l'électrode en fil/tige de platine ? Le guide essentiel des contre-électrodes
- Quelle est la différence entre RDE et RRDE ? Débloquez l'analyse électrochimique avancée des réactions
- Quelle est la différence entre une électrode à disque rotatif et une électrode à disque-anneau rotatif ? Dévoilez des aperçus électrochimiques plus approfondis
- Quelle est l'application de l'RRDE ? Découvrez des informations quantitatives sur les catalyseurs et les réactions
- Quelles sont les spécifications de l'électrode fonctionnelle Platine-Titane ? Maximiser les performances électrochimiques



















