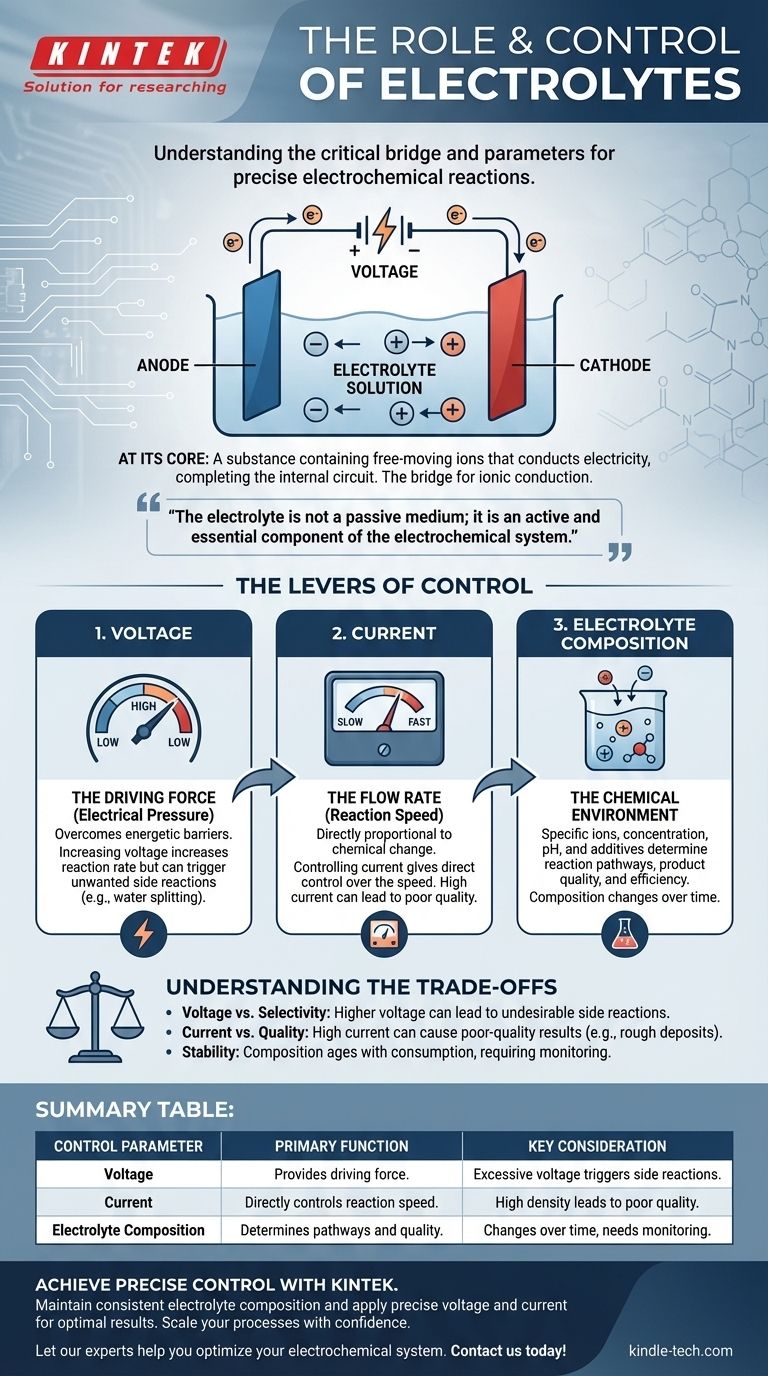
À la base, un électrolyte est une substance contenant des ions libres qui conduit l'électricité, complétant le circuit à l'intérieur d'une cellule électrochimique. C'est le pont critique qui permet à une réaction chimique d'être entraînée par une source d'énergie externe. La réaction elle-même est contrôlée précisément en ajustant trois paramètres clés : la tension appliquée, le courant résultant et la composition chimique de l'électrolyte.
L'électrolyte n'est pas un milieu passif ; c'est un composant actif et essentiel du système électrochimique. Comprendre comment manipuler les entrées électriques et la chimie de l'électrolyte est la clé pour transformer une réaction d'un processus de force brute en une opération contrôlée avec précision.

Le rôle fondamental de l'électrolyte
Pour contrôler un système, il faut d'abord comprendre ses composants non négociables. En électrochimie, l'électrolyte est la voie interne qui rend l'ensemble du processus possible.
Qu'est-ce qu'un électrolyte ?
Un électrolyte est généralement une solution contenant des sels, des acides ou des bases dissous, qui se dissocient en cations chargés positivement et en anions chargés négativement. Bien qu'il s'agisse souvent d'une solution aqueuse (à base d'eau), ils peuvent également être basés sur des solvants organiques ou même exister sous forme de sels fondus à haute température.
La propriété clé est la présence d'ions mobiles. Sans eux, le circuit interne est rompu et aucune réaction électrochimique ne peut se produire.
Le pont pour la conduction ionique
Une cellule électrochimique possède deux circuits. Le circuit externe est le câblage par lequel les électrons voyagent d'une électrode à l'autre.
Le circuit interne est l'électrolyte. Lorsque les électrons arrivent à une électrode (la cathode) et partent de l'autre (l'anode), les ions doivent se déplacer à travers l'électrolyte pour équilibrer la charge. Les cations se déplacent vers la cathode et les anions se déplacent vers l'anode, complétant le circuit électrique.
Plus qu'un simple conducteur
L'électrolyte participe également activement à la réaction. Sa composition détermine les espèces chimiques disponibles pour être oxydées ou réduites, quels seront les produits de la réaction et à quelle vitesse la réaction peut se dérouler.
Les leviers de contrôle : Comment gérer la réaction
Contrôler une réaction électrochimique signifie manipuler la vitesse et le résultat des changements chimiques se produisant aux électrodes. Ceci est réalisé en gérant les propriétés électriques et chimiques du système.
Contrôle de la tension (la force motrice)
La tension peut être considérée comme la "pression électrique" qui pousse la réaction vers l'avant. Une certaine tension minimale est requise pour surmonter la barrière énergétique d'une réaction spécifique.
L'augmentation de la tension augmente généralement le taux de réaction. Cependant, l'application d'une tension excessive est un instrument grossier qui peut déclencher des réactions secondaires indésirables.
Contrôle du courant (le débit)
Le courant est la mesure du nombre d'électrons circulant dans le circuit par unité de temps. Selon les lois de Faraday sur l'électrolyse, la quantité de changement chimique est directement proportionnelle à la quantité de charge passée.
Par conséquent, le contrôle du courant vous donne un contrôle direct sur la vitesse de la réaction. Un courant constant (contrôle galvanostatique) garantit que la réaction se déroule à un rythme régulier et prévisible.
Ajustement de la composition de l'électrolyte (l'environnement chimique)
C'est le niveau de contrôle le plus nuancé. Les ions spécifiques, leur concentration, le solvant et les additifs modifient fondamentalement l'environnement de réaction.
Les facteurs clés incluent la concentration (qui affecte la conductivité et la disponibilité des ions), le pH (qui peut dicter les réactions possibles dans l'eau) et la présence d'additifs spécialisés qui peuvent inhiber la corrosion, éclaircir une finition plaquée ou modifier le résultat.
Comprendre les compromis
Un contrôle précis exige une prise de conscience des limites et des conséquences de chaque ajustement. Pousser un paramètre à l'extrême compromet souvent un autre.
Le problème tension vs. sélectivité
Bien qu'une tension plus élevée augmente le taux, elle peut également fournir suffisamment d'énergie pour initier des réactions indésirables. Par exemple, dans une solution aqueuse, une tension excessive peut commencer à scinder l'eau en hydrogène et en oxygène, consommant de l'énergie et réduisant l'efficacité de votre objectif principal.
Densité de courant et qualité
Pousser pour un courant très élevé (et donc un taux de réaction élevé) peut entraîner des résultats de mauvaise qualité. En galvanoplastie, un courant trop élevé peut entraîner l'épuisement des ions près de la surface de l'électrode, ce qui donne un dépôt rugueux, poreux ou brûlé. La qualité exige souvent de la patience et une densité de courant plus faible.
Stabilité et durée de vie de l'électrolyte
L'électrolyte n'est pas statique. Sa composition change pendant la réaction à mesure que les ions sont consommés et que des contaminants sont introduits. Les solvants peuvent s'évaporer et les additifs peuvent être épuisés. Ce "vieillissement" de l'électrolyte est une source principale d'incohérence dans les processus industriels de longue durée et nécessite une surveillance et une maintenance.
Faire le bon choix pour votre objectif
Votre stratégie de contrôle dépend entièrement de ce que vous voulez réaliser. Utilisez ces principes pour guider votre approche.
- Si votre objectif principal est de maximiser la vitesse de réaction : Utilisez un courant plus élevé et assurez-vous que la concentration de l'électrolyte est suffisamment élevée pour supporter ce taux sans épuisement significatif des ions près des électrodes.
- Si votre objectif principal est d'atteindre une grande précision ou qualité : Utilisez une densité de courant plus faible et soigneusement contrôlée ou appliquez une tension spécifique (contrôle potentiostatique) pour vous assurer que la réaction se déroule en douceur et de manière sélective.
- Si votre objectif principal est de résoudre un problème de processus incohérent : Commencez par analyser l'électrolyte. Sa composition, sa concentration et sa contamination potentielle sont les sources les plus courantes de variabilité du processus.
La maîtrise de ces principes transforme un processus électrochimique d'une boîte noire en un système réglable avec précision.
Tableau récapitulatif :
| Paramètre de contrôle | Fonction principale | Considération clé |
|---|---|---|
| Tension | Fournit la force motrice de la réaction. | Une tension excessive peut déclencher des réactions secondaires indésirables. |
| Courant | Contrôle directement la vitesse de la réaction. | Une densité de courant élevée peut entraîner des résultats de mauvaise qualité. |
| Composition de l'électrolyte | Détermine les voies de réaction et la qualité du produit. | La composition change au fil du temps, nécessitant une surveillance. |
Prêt à obtenir un contrôle précis sur vos processus électrochimiques ?
Chez KINTEK, nous sommes spécialisés dans la fourniture d'équipements de laboratoire et de consommables de haute qualité dont vous avez besoin pour maîtriser vos réactions. Que vous développiez de nouveaux matériaux, réalisiez de la galvanoplastie ou meniez des recherches, nos solutions vous aident à :
- Maintenir une composition d'électrolyte constante pour des résultats fiables.
- Appliquer un contrôle précis de la tension et du courant pour une sélectivité et une qualité optimales.
- Faire évoluer vos processus du banc de laboratoire à la production en toute confiance.
Laissez nos experts vous aider à optimiser votre système électrochimique. Contactez-nous dès aujourd'hui pour discuter de votre application et de vos défis spécifiques !
Guide Visuel
Produits associés
- Cellule de diffusion de gaz électrolytique électrochimique à flux liquide
- Cellule électrolytique optique à double couche de type H avec bain-marie
- Cellule électrochimique électrolytique en quartz pour expériences électrochimiques
- Cellule électrolytique en PTFE Cellule électrochimique scellée et non scellée résistante à la corrosion
- Cellule électrochimique électrolytique pour l'évaluation des revêtements
Les gens demandent aussi
- Quelle est la précaution concernant la température lors de l'utilisation d'une cellule électrolytique entièrement en PTFE ? Conseils essentiels de sécurité thermique
- Quels paramètres doivent être strictement contrôlés à l'aide d'une cellule électrolytique entièrement en PTFE ? Assurer la précision et la sécurité
- Quelles fonctions les cellules électrolytiques remplissent-elles dans la dissociation de l'eau PEC ? Optimisez votre recherche photoélectrochimique
- Quel est le but de l'utilisation d'un tube en verre fritté dans une cellule à trois électrodes ? Améliorer la précision des tests d'oxydoréduction du vanadium
- Quels avantages les cellules électrolytiques à flux offrent-elles par rapport aux cellules de type H ? Optimiser l'efficacité de l'électrolyse du CO2



















