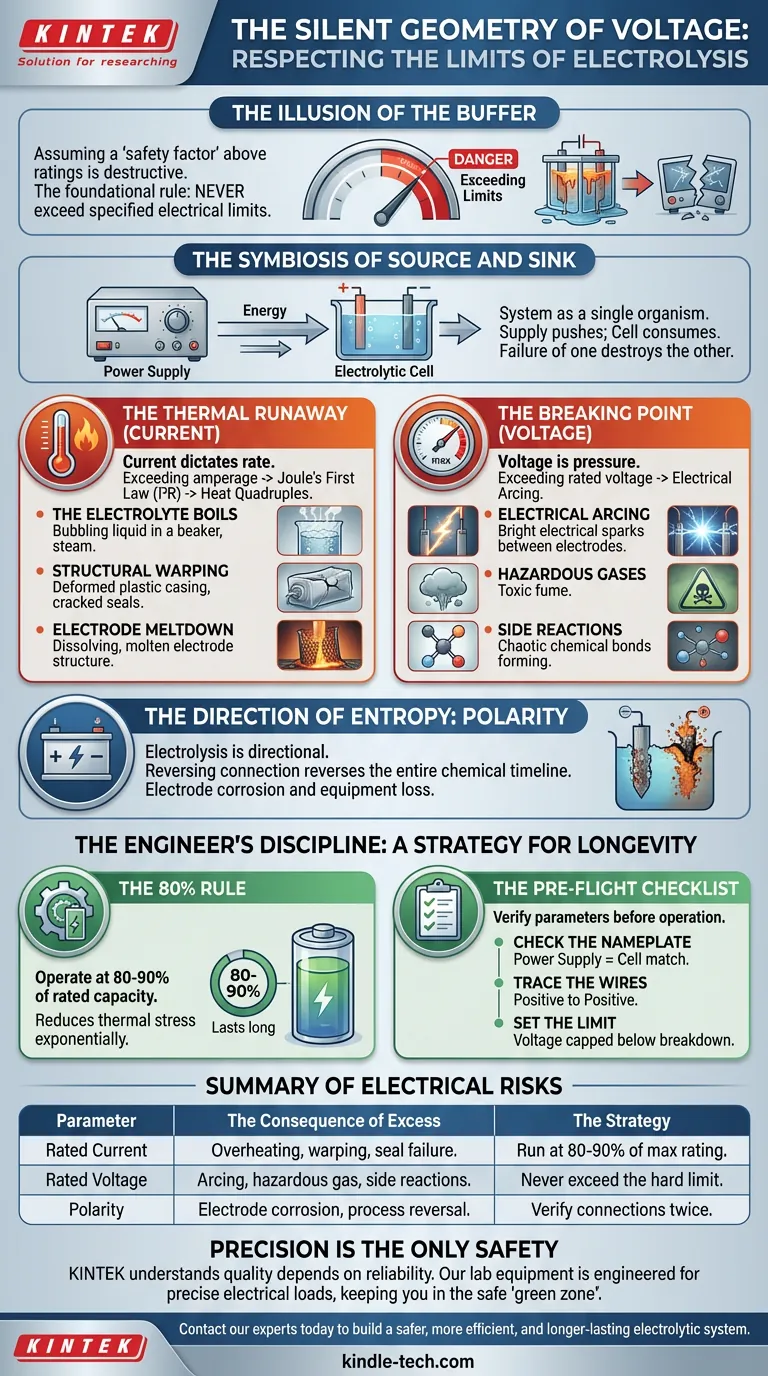
L'illusion du tampon
En ingénierie et en sciences de laboratoire, nous opérons souvent avec une croyance implicite dans le « facteur de sécurité ». Nous supposons qu'un pont peut supporter plus que sa limite de poids, ou qu'un bécher peut résister à quelques degrés au-dessus de sa valeur nominale.
Nous supposons que la ligne rouge sur le cadran est une suggestion, pas un précipice.
Dans le monde de l'électrolyse, cette mentalité n'est pas seulement fausse ; elle est destructrice. La règle fondamentale du fonctionnement d'une cellule électrolytique est absolue : ne jamais dépasser les limites électriques spécifiées de vos composants.
Il ne s'agit pas de conformité bureaucratique. Il s'agit de physique.
Les valeurs nominales de courant (ampérage) et de tension sont les limites où la chimie fonctionne de manière prévisible. Si vous sortez de ces limites, vous entrez dans un état chaotique où l'équipement fond, les électrolytes se décomposent et la sécurité s'évapore.
La symbiose de la source et du puits
Pour comprendre le risque, nous devons examiner le système comme un seul organisme.
L'alimentation électrique et la cellule électrolytique sont symbiotiques. L'alimentation électrique pousse l'énergie ; la cellule la consomme. Si la cellule demande plus que ce que l'alimentation peut fournir, l'alimentation grille. Si l'alimentation force plus que ce que la cellule peut accepter, la cellule se dégrade.
Il n'y a pas d'isolement ici. La défaillance d'un composant garantit presque toujours la destruction de l'autre.
L'emballement thermique (courant)
Le courant est la mesure du débit. Dans l'électrolyse, il dicte le taux de réaction. Il est tentant d'augmenter le cadran pour accélérer le processus.
Mais le courant génère de la chaleur.
Chaque conducteur a une résistance. Selon la première loi de Joule ($I^2R$), doubler le courant ne double pas seulement la chaleur, il la quadruple.
Lorsque vous dépassez l'ampérage nominal :
- L'électrolyte bout : Le stress thermique modifie la composition chimique.
- Déformation structurelle : Les joints échouent et les boîtiers en plastique se déforment.
- Fusion des électrodes : La structure physique de l'électrode ne peut pas dissiper l'énergie assez rapidement.
Le point de rupture (tension)
Si le courant est le débit, la tension est la pression.
Dépasser la tension nominale équivaut à surpressuriser un tuyau. L'énergie doit aller quelque part. Dans une cellule électrolytique, l'excès de tension entraîne souvent des arcs électriques.
Cela force l'électrolyte à se décomposer d'une manière que vous n'aviez pas prévue. Cela crée des réactions secondaires, produisant des gaz dangereux ou contaminant votre produit pur. Vous ne faites plus de chimie ; vous créez du chaos.
La direction de l'entropie : la polarité
Il existe une troisième variable, souvent négligée dans la hâte de commencer : la polarité.
L'électrolyse est strictement directionnelle. L'anode (positive) et la cathode (négative) sont des environnements chimiquement distincts.
Inverser la connexion n'est pas une erreur mineure. Cela inverse toute la chronologie chimique. Une électrode conçue pour être inerte peut soudainement commencer à se corroder et à se dissoudre dans votre solution.
Vous ne perdez pas seulement du temps. Vous perdez l'équipement.
La discipline de l'ingénieur : une stratégie pour la longévité
Comment éviter cela ? En passant de la mentalité de « capacité maximale » à celle de « fiabilité optimale ».
Les opérateurs les plus expérimentés ne font pas fonctionner leurs machines à la limite. Ils comprennent que la longévité est une fonction de la retenue.
La règle des 80 %
Si votre objectif est la longévité de l'équipement, ne faites jamais fonctionner votre système à 100 % de sa capacité nominale.
Faites fonctionner à 80-90 %.
Ce tampon de 10 à 20 % réduit le stress thermique de manière exponentielle. C'est la différence entre une cellule qui dure un mois et une qui dure un an.
La liste de contrôle avant le vol
Traitez votre installation électrolytique comme un avion. Avant de tourner l'interrupteur, les paramètres doivent être vérifiés.
- Vérifiez la plaque signalétique : L'alimentation correspond-elle à la cellule ?
- Suivez les fils : Le positif est-il connecté au positif ?
- Définissez la limite : La tension est-elle plafonnée en dessous du seuil de rupture ?
Résumé des risques électriques
| Paramètre | La conséquence de l'excès | La stratégie |
|---|---|---|
| Courant nominal | Surchauffe, déformation, défaillance des joints. | Fonctionner à 80-90 % de la puissance maximale. |
| Tension nominale | Arcs électriques, gaz dangereux, réactions secondaires. | Ne jamais dépasser la limite stricte. |
| Polarité | Corrosion des électrodes, inversion du processus. | Vérifier les connexions deux fois. |
La précision est la seule sécurité
En électrolyse, la sécurité n'est pas une fonctionnalité distincte. C'est le résultat naturel de la précision.
Chez KINTEK, nous comprenons que la qualité de vos résultats dépend de la fiabilité de vos outils. Notre équipement de laboratoire et nos consommables sont conçus pour supporter des charges électriques précises, vous donnant le contrôle dont vous avez besoin pour rester dans la « zone verte » de fonctionnement sécuritaire.
Ne laissez pas vos processus chimiques au hasard ou à des composants de qualité inférieure.
Contactez nos experts dès aujourd'hui pour discuter de la manière dont KINTEK peut vous aider à construire un système électrolytique plus sûr, plus efficace et plus durable.
Guide Visuel
Produits associés
- Matériau de polissage d'électrodes pour expériences électrochimiques
- Feuille de carbone vitreux RVC pour expériences électrochimiques
- Tissu de carbone conducteur, papier de carbone, feutre de carbone pour électrodes et batteries
- Mousse de cuivre
- Bride de passage d'électrode ultra-vide pour applications de haute précision
Articles associés
- Guide complet sur l'utilisation de l'électrode à disque rotatif (EDR) dans les études électrochimiques
- Électrodes électrochimiques dans l'analyse chimique
- Techniques avancées d'évaluation des revêtements à l'aide de cellules électrolytiques
- Comment choisir la bonne électrode électrochimique
- Électrolytes et électrodes électrochimiques




















