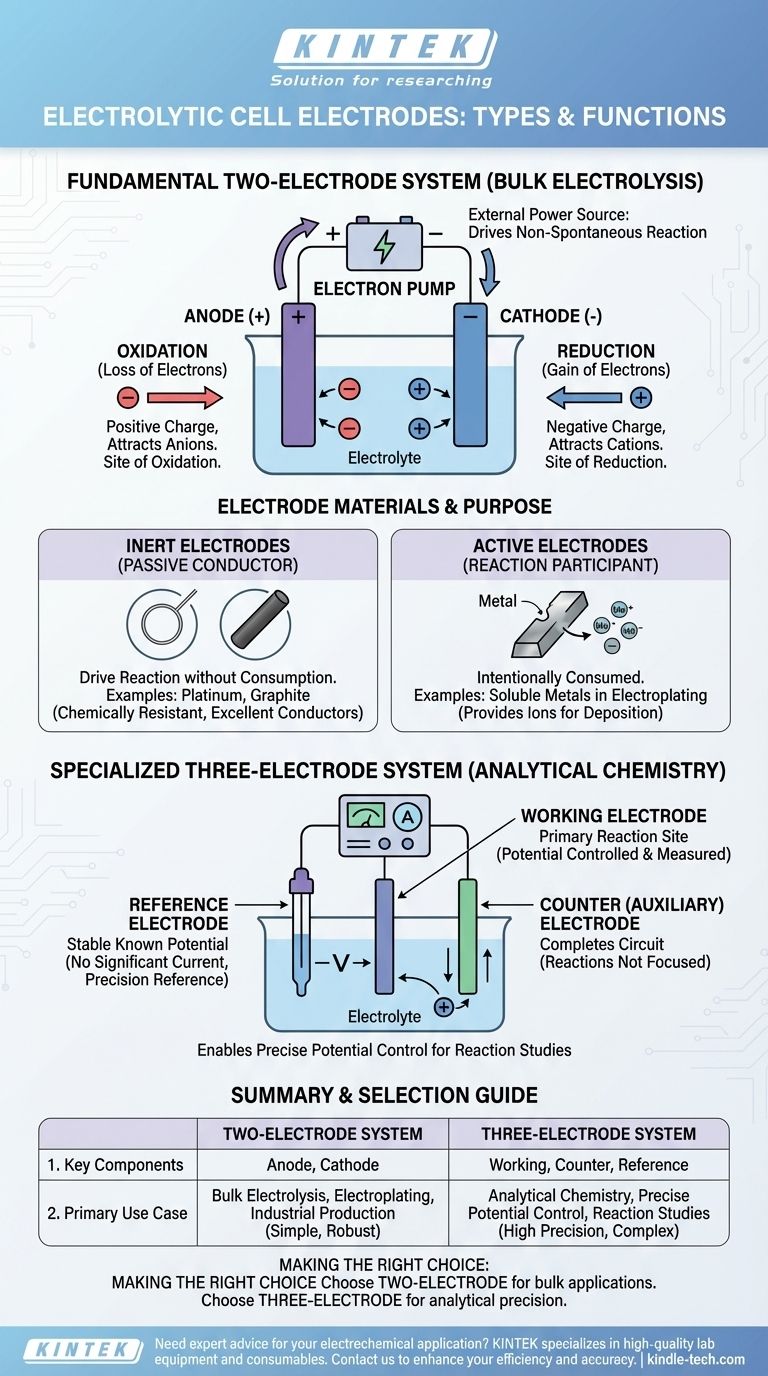
À la base, une cellule électrolytique utilise deux électrodes primaires : une anode chargée positivement où se produit l'oxydation, et une cathode chargée négativement où se produit la réduction. Pour un travail analytique plus précis, un système à trois électrodes est utilisé, composé d'une électrode de travail, d'une électrode auxiliaire et d'une électrode de référence.
Le type et le nombre d'électrodes utilisées dans une cellule électrolytique sont déterminés par son objectif. Une simple configuration à deux électrodes (anode et cathode) est suffisante pour provoquer une réaction chimique, tandis qu'un système à trois électrodes est nécessaire pour la mesurer et la contrôler avec précision.

Le système fondamental à deux électrodes
La plupart des cellules électrolytiques, des démonstrations en classe à la production à l'échelle industrielle, sont construites sur une base à deux électrodes. Ce système utilise une source d'alimentation externe pour forcer une réaction chimique non spontanée à se produire.
L'anode : site d'oxydation
L'anode est l'électrode connectée à la borne positive de la source d'alimentation. En raison de sa charge positive, elle attire les ions chargés négativement (anions) de la solution électrolytique. À la surface de l'anode, ces ions perdent des électrons dans un processus appelé oxydation.
La cathode : site de réduction
Inversement, la cathode est connectée à la borne négative de l'alimentation. Sa charge négative attire les ions chargés positivement (cations). À la surface de la cathode, ces ions gagnent des électrons dans un processus connu sous le nom de réduction.
Le rôle de la source d'alimentation externe
Contrairement à une batterie (une pile galvanique) qui génère de la tension, une cellule électrolytique en consomme. La source d'alimentation agit comme une "pompe à électrons", tirant les électrons de l'anode et les poussant vers la cathode, imposant ainsi la charge et entraînant l'ensemble du processus.
Matériaux des électrodes et leur but
Le matériau dont est faite une électrode est essentiel au fonctionnement de la cellule. Le choix dépend de la question de savoir si l'électrode doit être un participant actif ou un observateur passif de la réaction.
Électrodes inertes : le conducteur passif
Dans de nombreuses applications, l'objectif est de provoquer une réaction au sein de l'électrolyte sans que l'électrode elle-même ne soit consommée. Dans ces cas, des électrodes inertes sont utilisées. Des matériaux comme le platine et le graphite (une forme de carbone) sont des choix courants car ce sont d'excellents conducteurs électriques, mais ils sont chimiquement résistants et peu susceptibles de réagir.
Électrodes actives : le participant à la réaction
Dans certains processus, tels que la galvanoplastie ou le raffinage, l'anode est intentionnellement conçue pour être consommée. Une électrode active est faite d'un matériau qui s'oxyde et se dissout dans l'électrolyte, fournissant les ions métalliques qui seront ensuite déposés sur la cathode.
Le système spécialisé à trois électrodes
Pour la chimie analytique, où l'objectif est d'étudier une réaction plutôt que d'effectuer une électrolyse en vrac, un système à trois électrodes plus sophistiqué est nécessaire. Cette configuration permet un contrôle extrêmement précis du potentiel de l'électrode.
L'électrode de travail
C'est l'électrode principale où se produit la réaction d'intérêt. Son potentiel électrique est la variable soigneusement contrôlée et mesurée.
L'électrode auxiliaire (ou contre-électrode)
Le seul but de l'électrode auxiliaire est de compléter le circuit électrique. Le courant circule entre l'électrode de travail et l'électrode auxiliaire, mais les réactions se produisant à l'électrode auxiliaire ne sont pas le centre de l'expérience.
L'électrode de référence
C'est la clé de la précision du système. Une électrode de référence fournit un potentiel électrique stable et connu. Aucun courant significatif ne la traverse, de sorte que son potentiel reste constant. En mesurant le potentiel de l'électrode de travail par rapport à cette référence stable, un chercheur peut connaître et contrôler sa tension avec une grande précision.
Comprendre les compromis
Le choix d'un système implique d'équilibrer la simplicité et le besoin de contrôle.
Le système à deux électrodes : simplicité pour la production
Cette configuration est simple, robuste et idéale pour les applications à grande échelle comme la production de chlore gazeux ou d'aluminium. Sa limitation est un manque de contrôle précis du potentiel, car la tension appliquée est divisée de manière imprévisible entre les deux électrodes et l'électrolyte.
Le système à trois électrodes : précision pour l'analyse
Ce système offre un contrôle exquis, essentiel pour l'étude des mécanismes de réaction et la réalisation d'analyses électrochimiques sensibles. Cependant, il est plus complexe et généralement utilisé pour les travaux de laboratoire à faible courant, et non pour la production industrielle.
Faire le bon choix pour votre objectif
Votre objectif dicte la configuration d'électrode nécessaire.
- Si votre objectif principal est l'électrolyse en vrac ou une simple démonstration (par exemple, la décomposition de l'eau, la galvanoplastie) : Un système à deux électrodes (anode et cathode) fait de matériaux appropriés est le choix correct et le plus efficace.
- Si votre objectif principal est la mesure analytique ou l'étude d'un mécanisme de réaction : Un système à trois électrodes (de travail, auxiliaire, de référence) est essentiel pour la précision et le contrôle requis.
En fin de compte, comprendre la fonction de chaque électrode vous permet de sélectionner les bons outils pour la tâche chimique à accomplir.
Tableau récapitulatif :
| Système d'électrodes | Composants clés | Cas d'utilisation principal |
|---|---|---|
| Deux électrodes | Anode (oxydation), Cathode (réduction) | Électrolyse en vrac, Galvanoplastie, Production industrielle |
| Trois électrodes | Électrodes de travail, auxiliaire, de référence | Chimie analytique, Contrôle précis du potentiel, Études de réaction |
Besoin de conseils d'experts pour choisir les bonnes électrodes pour votre application électrochimique ? KINTEK est spécialisé dans les équipements de laboratoire et les consommables de haute qualité pour tous vos besoins en laboratoire. Que vous mettiez en place une production industrielle ou un travail analytique précis, notre équipe peut vous aider à choisir le système optimal pour améliorer votre efficacité et votre précision. Contactez-nous dès aujourd'hui pour discuter de vos besoins spécifiques !
Guide Visuel
Produits associés
- Électrode de référence au sulfate de cuivre pour usage en laboratoire
- Électrode en feuille de platine pour applications de laboratoire et industrielles
- Électrode en feuille de platine pour applications en laboratoire de batteries
- Bain-marie électrochimique multifonctionnel pour cellule électrolytique, simple ou double couche
- Collecteur de courant en feuille d'aluminium pour batterie au lithium
Les gens demandent aussi
- Quels sont les avantages et les inconvénients de l'électrode de référence au sulfate de cuivre de type à noyau céramique ?
- Quelles sont les procédures post-traitement après l'utilisation d'une électrode de référence au sulfate de cuivre ? Étapes essentielles pour la précision et la longévité
- Quelles sont les étapes de prétraitement avant d'utiliser une électrode de référence portable au sulfate de cuivre ? Assurer des mesures précises du potentiel de corrosion
- Y a-t-il une différence de performance entre les électrodes au sulfate de cuivre à bouchon de bois et à noyau céramique ? Vitesse vs Durabilité expliquée
- Quelle est la durée de vie prévue d'une électrode de référence au sulfate de cuivre ? Maximisez la longévité grâce à un entretien approprié