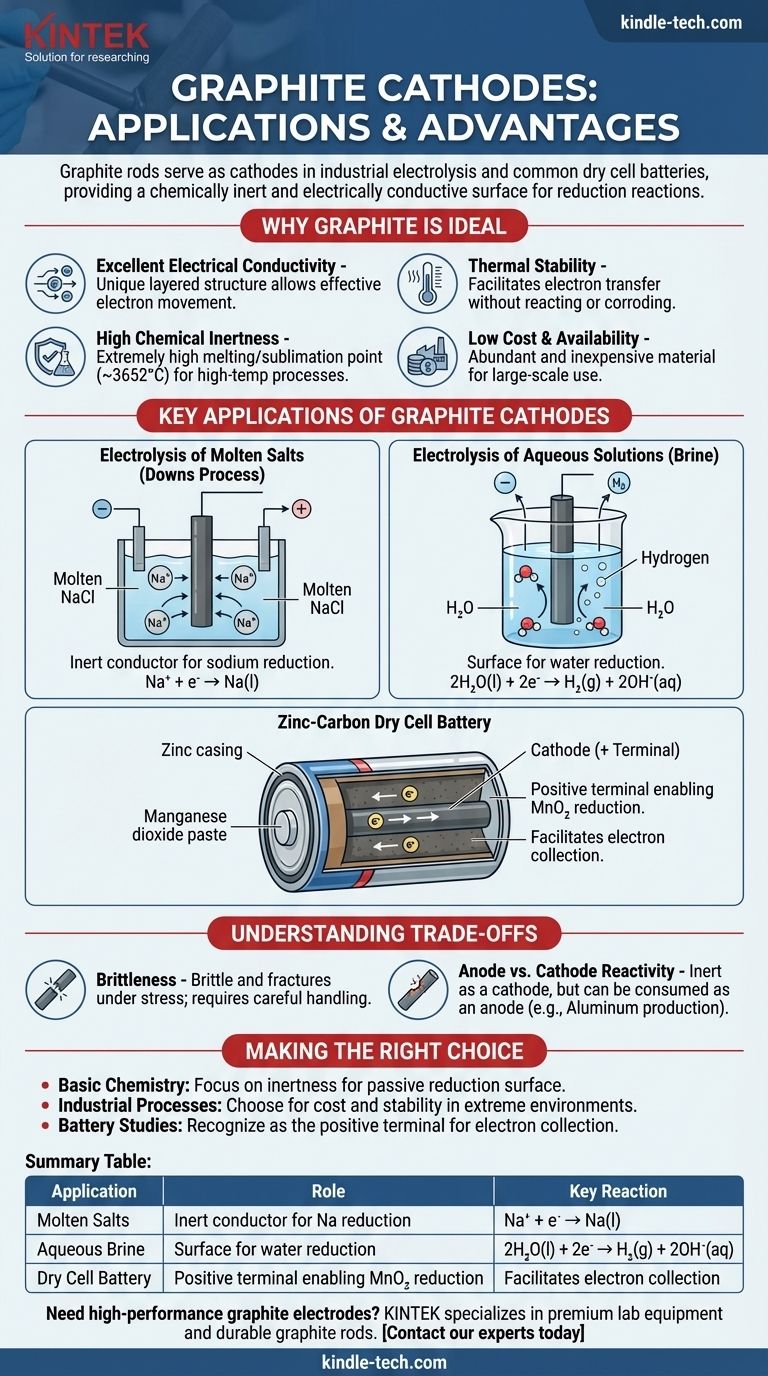
Les tiges de graphite servent de cathodes dans plusieurs processus électrochimiques clés, notamment dans l'électrolyse industrielle des sels et au sein des piles sèches courantes. Dans ces applications, la fonction principale de la tige de graphite n'est pas d'être consommée ou de réagir, mais d'agir comme une surface chimiquement inerte et électriquement conductrice où une réaction de réduction peut avoir lieu.
Le graphite est choisi comme matériau de cathode non pas parce qu'il participe à la réaction primaire, mais parce qu'il est un excellent conducteur inerte. Sa combinaison unique de conductivité électrique, de résistance chimique, de stabilité thermique élevée et de faible coût en fait une plateforme idéale pour que la demi-réaction de réduction se produise.

Pourquoi le graphite est un matériau de cathode idéal
Le choix d'un matériau pour une électrode est une décision de conception critique dans toute cellule électrochimique. Le graphite (une forme spécifique de carbone) possède un ensemble de propriétés qui le rendent exceptionnellement bien adapté au rôle de cathode.
Excellente conductivité électrique
Le graphite a une structure unique en couches, plane. Au sein de ces couches, les électrons délocalisés sont libres de se déplacer, ce qui permet au graphite de conduire l'électricité très efficacement, une caractéristique nécessaire pour toute électrode.
Grande inertie chimique
En tant que cathode, l'électrode doit faciliter le transfert d'électrons vers une substance dans l'électrolyte sans réagir elle-même. Le carbone est relativement non réactif, surtout par rapport à la plupart des métaux, ce qui signifie qu'il ne se corrodera pas et n'interférera pas avec le processus chimique souhaité.
Stabilité thermique
Le graphite a l'un des points de fusion/sublimation les plus élevés de tous les éléments (environ 3652°C ou 6606°F). Cela le rend parfait pour les processus électrochimiques à haute température, comme l'électrolyse des sels fondus, où les électrodes métalliques fondraient.
Faible coût et disponibilité
D'un point de vue industriel, le graphite est un matériau abondant et peu coûteux. Cela rend la production électrochimique à grande échelle, qui nécessite de grandes électrodes, économiquement réalisable.
Applications clés des cathodes en graphite
Comprendre les cas d'utilisation spécifiques clarifie la théorie. Dans chaque exemple, la cathode en graphite est simplement l'endroit où les électrons sont livrés pour provoquer un changement chimique.
Électrolyse des sels fondus (procédé Downs)
Dans la production de sodium métallique pur à partir de chlorure de sodium fondu (NaCl), une tige de graphite est souvent utilisée comme cathode. Les ions sodium chargés positivement (Na⁺) sont attirés par la cathode chargée négativement, où ils gagnent un électron et sont réduits en sodium métallique liquide.
Na⁺ + e⁻ → Na(l)
La cathode en graphite fournit simplement la surface et les électrons pour cette réaction.
Électrolyse des solutions aqueuses (saumure)
Lors de l'électrolyse d'une solution aqueuse de chlorure de sodium (saumure), la cathode en graphite joue un rôle similaire. Cependant, dans ce cas, l'eau est plus facile à réduire que les ions sodium.
Par conséquent, les molécules d'eau sont réduites à la surface de la cathode en graphite, produisant de l'hydrogène gazeux et des ions hydroxyde.
2H₂O(l) + 2e⁻ → H₂(g) + 2OH⁻(aq)
La pile sèche zinc-carbone
Dans une pile "robuste" courante, la tige centrale est en graphite et agit comme cathode (la borne positive). Elle est entourée d'une pâte humide de dioxyde de manganèse (MnO₂) et d'autres produits chimiques.
La tige de graphite recueille les électrons du circuit externe. La réaction de réduction se produit dans la pâte adjacente à la tige, où le dioxyde de manganèse est réduit. Le graphite facilite simplement ce processus.
Comprendre les compromis
Bien que très efficace, le graphite n'est pas un matériau parfait. Reconnaître ses limites est essentiel pour comprendre ses applications.
Fragilité
Contrairement aux métaux, qui sont ductiles, le graphite est fragile et peut se fracturer sous un choc ou une contrainte mécanique. Cela nécessite une manipulation et un support soigneux dans les conceptions industrielles.
Réactivité anode vs cathode
Bien que le graphite soit très inerte en tant que cathode, il peut être consommé lorsqu'il est utilisé comme anode (le site d'oxydation) dans certains processus. Par exemple, dans la production d'aluminium, l'anode en carbone réagit avec l'oxygène produit pour former du CO₂ gazeux et est lentement rongée.
Confusion entre les types de cellules
Un point de confusion courant est la polarité des électrodes. La cathode est toujours le site de la réduction, mais son signe change en fonction du type de cellule.
- Dans une cellule électrolytique (comme pour l'électrolyse du sel), la cathode est la borne négative.
- Dans une cellule galvanique (comme une batterie), la cathode est la borne positive.
Faire le bon choix pour votre objectif
Votre raison de vous intéresser aux cathodes en graphite détermine l'aspect le plus important sur lequel se concentrer.
- Si votre objectif principal est la chimie de base : Rappelez-vous que le graphite est un conducteur inerte, fournissant une surface passive pour qu'une réaction de réduction se produise sans réagir lui-même.
- Si votre objectif principal est les processus industriels : Choisissez le graphite pour son rapport coût-efficacité et sa stabilité inégalée dans les environnements à haute température ou corrosifs où la plupart des métaux échoueraient.
- Si votre objectif principal est l'étude des batteries : Reconnaissez que la tige de graphite dans une pile zinc-carbone agit comme la borne positive (cathode), servant de collecteur d'électrons qui permet la réduction de la pâte chimique environnante.
En fin de compte, comprendre le rôle du graphite en tant que cathode, c'est reconnaître le pouvoir d'un matériau inerte et conducteur qui permet la chimie sans interférer avec elle.
Tableau récapitulatif :
| Application | Rôle de la cathode en graphite | Réaction clé |
|---|---|---|
| Électrolyse des sels fondus (procédé Downs) | Conducteur inerte pour la réduction du sodium | Na⁺ + e⁻ → Na(l) |
| Électrolyse de la saumure aqueuse | Surface pour la réduction de l'eau | 2H₂O(l) + 2e⁻ → H₂(g) + 2OH⁻(aq) |
| Pile sèche zinc-carbone | Borne positive permettant la réduction de MnO₂ | Facilite la collecte d'électrons |
Besoin d'électrodes en graphite haute performance pour vos processus électrochimiques ? KINTEK est spécialisé dans les équipements de laboratoire et les consommables haut de gamme, y compris les tiges de graphite durables conçues pour une conductivité et une stabilité thermique supérieures. Que vous réalisiez une électrolyse industrielle ou que vous développiez des technologies de batterie, nos matériaux garantissent des performances fiables et inertes. Contactez nos experts dès aujourd'hui pour trouver la solution graphite parfaite pour vos besoins en laboratoire !
Guide Visuel
Produits associés
- Plaque de graphite carboné fabriquée par la méthode de pressage isostatique
- Matériau de polissage d'électrodes pour expériences électrochimiques
- Four de graphitisation de film de haute conductivité thermique sous vide de graphite
- Four de graphitisation sous vide vertical à haute température
- Grand four de graphitisation sous vide vertical en graphite
Les gens demandent aussi
- Quel rôle joue la convection dans le transfert de chaleur ? Comprendre le mouvement de la chaleur dans les fluides
- Le graphite conduit-il l'électricité ? Dévoiler les secrets de sa structure atomique
- Quelle est la fonction du matériau graphite lors de la préparation des corps frittés de Ga-LLZO ? Assurer l'intégrité de l'échantillon dans le HIP
- Quelles sont les propriétés du graphite ? Découvrez sa résistance et sa conductivité à haute température
- Quels sont les avantages, les inconvénients et les utilisations de la tôle métallique ? Le guide ultime pour la sélection des matériaux



















