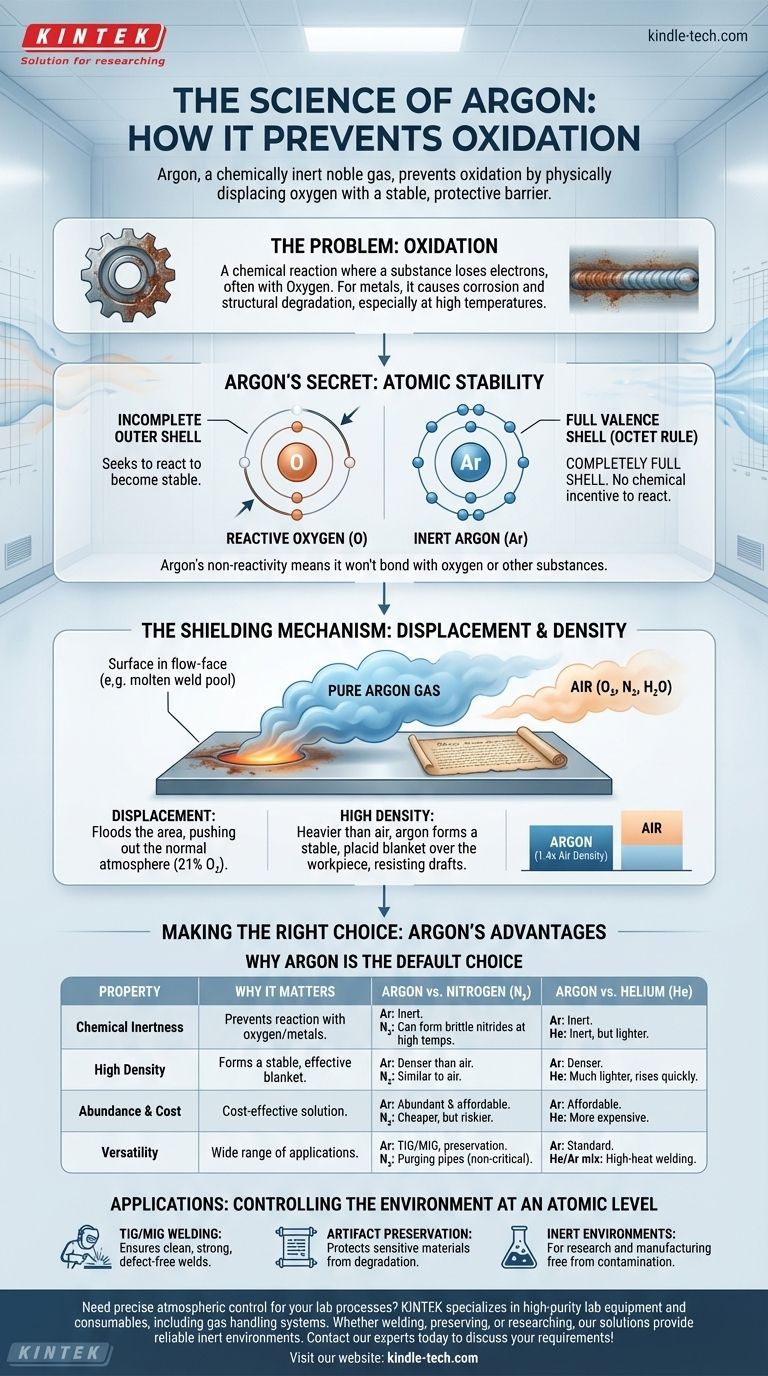
Essentiellement, l'argon empêche l'oxydation parce que c'est un gaz noble chimiquement inerte qui déplace physiquement l'oxygène d'une surface. Sa structure atomique le rend peu enclin à réagir avec d'autres éléments, tandis que sa densité lui permet de former une barrière protectrice stable qui bloque l'oxygène et d'autres contaminants atmosphériques.
La clé pour comprendre la puissance de l'argon est sa stabilité atomique. Avec une couche externe d'électrons parfaitement pleine, l'argon n'a aucune incitation chimique à réagir, ce qui en fait un bouclier idéal et non réactif contre la nature hautement réactive de l'oxygène.

La chimie de l'oxydation
Qu'est-ce que l'oxydation
L'oxydation est une réaction chimique au cours de laquelle une substance perd des électrons. Bien que le nom provienne de l'oxygène, qui est un agent très courant pour ce processus, elle peut également se produire avec d'autres éléments.
Pour les métaux, ce processus est communément appelé corrosion ou rouille. La réaction dégrade le matériau, affaiblissant sa structure et compromettant son intégrité.
Pourquoi c'est un problème
Dans des processus comme le soudage, le métal est chauffé à l'état fondu, ce qui le rend extrêmement vulnérable à l'oxydation. Le contact avec l'oxygène à ces températures peut créer des oxydes, entraînant des soudures fragiles, une mauvaise fusion et une défaillance structurelle catastrophique.
De même, des objets sensibles comme des documents historiques ou du bon vin peuvent être dégradés par une oxydation lente et à long terme due à l'air.
Le secret de l'argon : une couche de valence complète
La définition d'un gaz noble
L'argon appartient au groupe 18 du tableau périodique, connu sous le nom de gaz nobles. Ce groupe, qui comprend également l'hélium, le néon et le xénon, est défini par son extrême manque de réactivité chimique.
Le pouvoir de la règle de l'octet
La raison de cette inertie réside dans leur configuration électronique. Les atomes recherchent la stabilité, qu'ils atteignent généralement en ayant une couche externe (ou de valence) d'électrons complète, généralement huit. C'est ce qu'on appelle la règle de l'octet.
Considérez la couche de valence d'un atome comme un carnet de bal. Les atomes comme l'oxygène ont un carnet incomplet et recherchent agressivement des partenaires (électrons) pour devenir stables. L'argon, cependant, arrive avec un carnet de bal complètement rempli.
Pourquoi cela rend l'argon non réactif
Parce que la couche électronique externe de l'argon est déjà pleine, il n'a aucune tendance à perdre, gagner ou partager des électrons avec d'autres atomes. Il est chimiquement satisfait et stable.
Cette non-réactivité fondamentale signifie qu'il ne se liera pas à l'oxygène, au métal chaud ou à d'autres substances, même dans des conditions de chaleur ou de pression extrêmes. Il existe simplement comme une présence neutre.
Le mécanisme de blindage : déplacement et protection
Créer une zone sans oxygène
La principale façon dont l'argon protège une surface est par déplacement. En inondant une zone d'argon pur, vous repoussez physiquement l'atmosphère normale, qui se compose d'environ 21 % d'oxygène et 78 % d'azote, plus de la vapeur d'eau.
Cela crée un environnement localisé, sans oxygène, autour de la zone sensible, comme un bain de fusion ou un manuscrit ancien dans une vitrine.
Le rôle de la densité
L'argon est environ 1,4 fois plus dense que l'air. C'est une propriété physique essentielle pour les applications de blindage.
Parce qu'il est plus lourd, l'argon a tendance à couler et à former une couverture stable et calme sur la pièce à travailler. Cela offre une protection constante moins facilement perturbée par les courants d'air que les gaz plus légers comme l'hélium.
Comprendre les compromis
Pourquoi ne pas simplement utiliser de l'azote ?
L'azote gazeux (N₂) est souvent utilisé comme gaz de purge et est beaucoup moins cher que l'argon. Cependant, il n'est pas vraiment inerte.
Aux températures élevées du soudage, l'azote peut réagir avec certains métaux, comme le titane et certains aciers inoxydables, pour former des nitrures. Ces composés peuvent rendre le métal cassant, c'est pourquoi l'argon est nécessaire pour un processus chimiquement pur.
Argon vs. Hélium
L'hélium est le seul autre gaz noble couramment utilisé pour le blindage, mais il a des propriétés différentes. Il est beaucoup plus léger que l'air et a une conductivité thermique plus élevée.
Le transfert de chaleur plus élevé d'un mélange hélium-argon peut être utile pour souder des sections très épaisses de métaux conducteurs comme l'aluminium. Cependant, l'hélium est plus cher et sa faible densité signifie qu'il monte rapidement, nécessitant des débits plus élevés pour maintenir la couverture.
La rentabilité de l'argon
L'argon représente près de 1 % de l'atmosphère terrestre, ce qui en fait le plus abondant et le moins cher de tous les gaz nobles. Cette combinaison d'inertie parfaite, de densité idéale et d'abordabilité en fait le choix par défaut pour la grande majorité des applications de blindage.
Faire le bon choix pour votre application
Le choix d'un gaz de protection nécessite d'adapter ses propriétés à votre objectif spécifique.
- Si votre objectif principal est le soudage TIG ou MIG de la plupart des aciers et de l'aluminium : L'argon est la norme industrielle en raison de son excellente stabilité d'arc, de sa densité idéale et de sa rentabilité.
- Si votre objectif principal est la conservation d'artefacts sensibles ou de produits alimentaires : L'argon est supérieur car son inertie totale et sa densité créent une couverture protectrice permanente et non réactive.
- Si votre objectif principal est le soudage à grande vitesse ou à forte pénétration sur des métaux non ferreux épais : Un mélange argon/hélium spécialisé peut être nécessaire pour exploiter l'énergie thermique plus élevée de l'hélium.
- Si votre objectif principal est simplement de purger des tuyaux ou des conteneurs pour des applications non critiques : L'azote peut être un choix plus rentable, à condition qu'il ne réagisse pas avec les matériaux impliqués.
En fin de compte, comprendre la stabilité chimique de l'argon vous permet de contrôler l'environnement au niveau atomique.
Tableau récapitulatif :
| Propriété | Pourquoi c'est important pour la prévention de l'oxydation |
|---|---|
| Inertie chimique | L'argon ne réagit pas avec l'oxygène ou les métaux chauds, même à haute température. |
| Haute densité | Plus lourd que l'air, il forme une couverture stable qui déplace efficacement l'oxygène. |
| Abondance et coût | Représente 1 % de l'atmosphère, offrant une solution de blindage rentable. |
| Polyvalence | Idéal pour le soudage TIG/MIG, la conservation d'artefacts et la création d'environnements inertes. |
Besoin d'un contrôle atmosphérique précis pour vos processus de laboratoire ? KINTEK est spécialisé dans les équipements de laboratoire et les consommables de haute pureté, y compris les systèmes de manipulation de gaz, pour garantir que vos expériences et votre production sont exemptes de contamination. Que vous soudiez, conserviez des matériaux sensibles ou meniez des recherches, nos solutions fournissent les environnements inertes fiables dont vous avez besoin. Contactez nos experts dès aujourd'hui pour discuter de la manière dont nous pouvons répondre à vos exigences spécifiques en laboratoire !
Guide Visuel
Produits associés
- Four à atmosphère contrôlée 1200℃ Four à atmosphère inerte d'azote
- Four à atmosphère contrôlée 1700℃ Four à atmosphère inerte d'azote
- Four à atmosphère contrôlée de 1400℃ avec atmosphère d'azote et inerte
- Four à atmosphère d'hydrogène contrôlée à l'azote
- Four à tube de laboratoire à haute température de 1700℃ avec tube en alumine
Les gens demandent aussi
- Comment créer une atmosphère inerte ? Maîtrisez les procédés sûrs et purs grâce à l'inertage
- Comment développer une atmosphère inerte pour une réaction chimique ? Maîtrisez le contrôle atmosphérique précis pour votre laboratoire
- Qu'est-ce qui fournit une atmosphère inerte ? Atteignez la sécurité et la pureté avec l'azote, l'argon ou le CO2
- Le gaz azote peut-il être chauffé ? Exploitez la chaleur inerte pour la précision et la sécurité
- Pourquoi l'azote est-il utilisé dans les fours de recuit ? Pour prévenir l'oxydation et la décarburation afin d'obtenir une qualité de métal supérieure



















