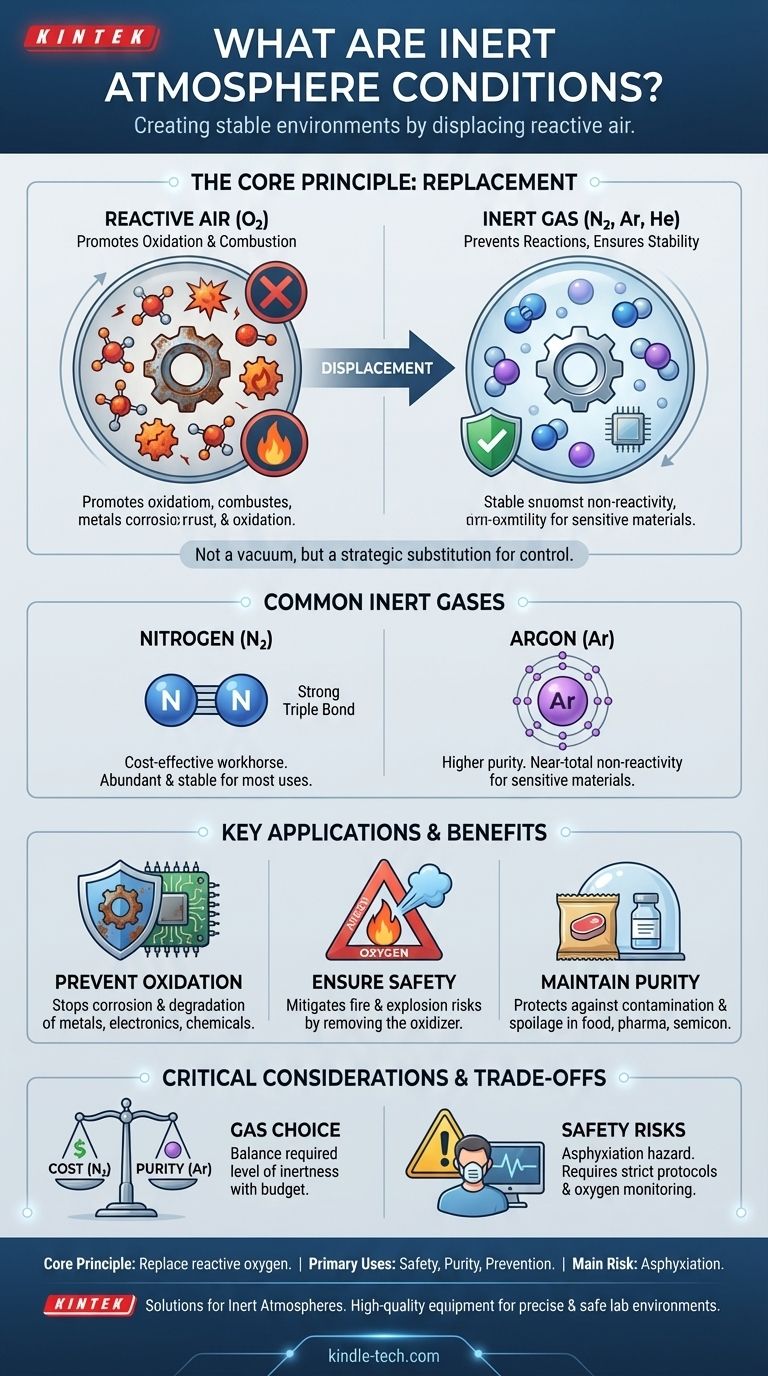
En bref, les conditions d'atmosphère inerte sont des environnements où l'air normal et réactif a été intentionnellement remplacé par un gaz non réactif (inerte). Ceci est fait pour prévenir les réactions chimiques indésirables, principalement l'oxydation et la combustion, en éliminant l'oxygène qui les alimente. L'objectif est de créer un environnement stable et prévisible pour les matériaux ou les processus sensibles.
Une atmosphère inerte n'est pas un vide ou une absence de gaz ; c'est le remplacement délibéré d'une atmosphère réactive (comme l'air) par une atmosphère non réactive. Cette substitution stratégique est la clé pour contrôler la stabilité chimique, assurer la sécurité et préserver la pureté des matériaux.

Le Principe Fondamental : Remplacer les Éléments Réactifs
Pour comprendre les atmosphères inertes, il faut d'abord comprendre ce qui rend un gaz « inerte ». C'est une question de stabilité chimique.
Qu'est-ce qui rend un gaz « inerte » ?
Un gaz inerte est un gaz qui ne participe pas facilement aux réactions chimiques dans un ensemble de conditions donné. Cette stabilité provient généralement d'une couche d'électrons externe complète.
Les gaz inertes les plus courants sont les gaz nobles (comme l'argon et l'hélium) et, à des fins pratiques, l'**Azote (N₂)**. L'azote est extrêmement stable en raison de la puissante triple liaison qui maintient ses deux atomes ensemble, nécessitant une grande quantité d'énergie pour être rompue.
La Cible Principale : Déplacer l'Oxygène
La principale raison de créer une atmosphère inerte est de déplacer l'**oxygène**. L'oxygène est très réactif et est le moteur principal de nombreux processus indésirables.
Ces processus comprennent l'**oxydation** (comme la rouille sur le métal ou la détérioration des aliments), la **combustion** (feu) et la dégradation des composés chimiques sensibles. En éliminant l'oxygène, vous éliminez l'ingrédient clé de ces réactions.
Applications Clés et Avantages
L'utilisation d'une atmosphère inerte offre une protection essentielle dans de nombreux domaines scientifiques et industriels. Ses avantages sont directement liés aux problèmes qu'elle résout en éliminant les gaz réactifs.
Prévention de l'Oxydation et de la Corrosion
De nombreux matériaux, des poudres métalliques aux composants électroniques en passant par les produits chimiques fins, se dégradent lorsqu'ils sont exposés à l'air.
Une couverture de gaz inerte empêche l'oxygène et l'humidité d'atteindre la surface du matériau, prolongeant considérablement sa durée de vie et préservant ses propriétés souhaitées. Ceci est fondamental dans la fabrication de haute technologie et le stockage chimique.
Assurer la Sécurité : Atténuer les Risques d'Incendie et d'Explosion
Le feu nécessite trois éléments : le combustible, la chaleur et un oxydant (généralement l'oxygène). C'est souvent appelé le triangle du feu.
En déplaçant l'oxygène avec un gaz inerte comme l'azote ou l'argon, vous supprimez l'une des jambes essentielles du triangle. Cette technique, connue sous le nom d'**inertage**, est une mesure de sécurité essentielle utilisée dans les réacteurs chimiques et les réservoirs de carburant pour prévenir les explosions catastrophiques.
Maintenir la Pureté et la Stabilité du Produit
Dans des domaines tels que la pharmacie, l'emballage alimentaire et la fabrication de semi-conducteurs, même des traces de contamination peuvent ruiner un produit.
Une atmosphère inerte protège contre les contaminants microbiens en suspension dans l'air et empêche la lente dégradation du produit lui-même. C'est pourquoi les sacs de croustilles sont remplis d'azote : cela empêche les croustilles de devenir rances (s'oxyder) et fournit un coussin protecteur.
Comprendre les Compromis et les Considérations
Bien qu'incroyablement utile, la mise en œuvre d'une atmosphère inerte nécessite une planification minutieuse et une conscience des inconvénients potentiels.
Le Choix du Gaz Compte : Coût vs Pureté
**L'azote** est le cheval de bataille de l'inertage. Il est abondant (constituant environ 78 % de l'air) et relativement peu coûteux à produire.
**L'argon** est nettement plus inerte que l'azote, surtout à haute température où l'azote peut parfois réagir avec les métaux. Cependant, il est également beaucoup plus rare et plus cher. Le choix dépend du niveau de pureté requis par rapport au budget du projet.
Le Danger Critique de l'Asphyxie
Une atmosphère inerte est, par définition, une atmosphère irrespirable. Le déplacement de l'oxygène présente un risque grave et souvent silencieux pour le personnel.
Toute zone utilisant un gaz inerte doit avoir des protocoles de sécurité stricts, y compris la surveillance de l'oxygène, une signalisation claire et des procédures de ventilation appropriées. L'entrée accidentelle dans un espace inerté peut provoquer une asphyxie immédiate.
Atteindre et Maintenir l'Atmosphère
La création d'un environnement inerte nécessite des équipements spécialisés tels que des boîtes à gants ou des lignes Schlenk pour le travail en laboratoire, ou des systèmes de purge complexes pour les récipients industriels.
Le principal défi est d'empêcher les fuites. Étant donné que l'air ambiant est riche en oxygène, même une petite fuite peut rapidement compromettre l'intégrité de l'atmosphère inerte, annulant ses avantages protecteurs.
Faire le Bon Choix pour Votre Objectif
Le meilleur gaz inerte est déterminé entièrement par les exigences spécifiques de votre application en matière de réactivité, de température et de coût.
- Si votre objectif principal est le revêtement économique à grande échelle : L'azote est la norme industrielle par défaut en raison de son faible coût et de son inertie suffisante pour la plupart des applications courantes.
- Si votre objectif principal est la métallurgie à haute température ou la protection de matériaux extrêmement sensibles : L'argon est le choix supérieur pour sa non-réactivité quasi totale, justifiant son coût plus élevé.
- Si votre objectif principal est une application spécialisée comme le soudage de certains alliages ou la détection de fuites : Un mélange d'hélium ou un mélange de gaz spécifique pourrait être nécessaire pour obtenir les propriétés techniques souhaitées.
En fin de compte, maîtriser les atmosphères inertes consiste à contrôler délibérément l'environnement chimique pour obtenir des résultats prévisibles, sûrs et de haute qualité.
Tableau Récapitulatif :
| Aspect Clé | Description |
|---|---|
| Principe de Base | Remplace l'air réactif (oxygène) par des gaz non réactifs pour prévenir les réactions chimiques indésirables. |
| Gaz Courants | Azote (économique), Argon (haute pureté), Hélium (usages spécialisés). |
| Utilisations Principales | Prévention de l'oxydation/corrosion, atténuation des risques d'incendie/explosion, maintien de la pureté du produit. |
| Équipement Clé | Boîtes à gants, lignes Schlenk, systèmes de purge industriels. |
| Considération Principale | Risques de sécurité (asphyxie), coût du gaz par rapport à la pureté, et maintien de l'intégrité de l'atmosphère. |
Besoin de créer un environnement stable, sûr et pur pour vos processus de laboratoire ? KINTEK est spécialisée dans la fourniture d'équipements et de consommables de laboratoire de haute qualité, y compris des solutions pour générer et maintenir des atmosphères inertes. Que vous ayez besoin d'un revêtement d'azote économique ou de systèmes d'argon de haute pureté pour des matériaux sensibles, notre expertise garantit que votre laboratoire fonctionne avec précision et sécurité. Contactez-nous dès aujourd'hui pour discuter de la manière dont nous pouvons soutenir vos besoins spécifiques en laboratoire !
Guide Visuel
Produits associés
- Four à atmosphère contrôlée de 1400℃ avec atmosphère d'azote et inerte
- Four à atmosphère contrôlée 1200℃ Four à atmosphère inerte d'azote
- Four à atmosphère contrôlée 1700℃ Four à atmosphère inerte d'azote
- Four à atmosphère d'hydrogène contrôlée à l'azote
- Four à tube de laboratoire à haute température de 1400℃ avec tube en alumine
Les gens demandent aussi
- Quelles sont les fonctions de l'azote (N2) dans les atmosphères de four contrôlées ? Obtenez d'excellents résultats de traitement thermique.
- Pourquoi l'azote est-il utilisé dans un four ? Un bouclier rentable pour les processus à haute température
- Pourquoi l'azote est-il utilisé dans les fours de recuit ? Pour prévenir l'oxydation et la décarburation afin d'obtenir une qualité de métal supérieure
- Comment un four à haute température avec contrôle d'atmosphère optimise-t-il les revêtements de spinelle ? Atteindre la précision du frittage redox
- Le gaz azote peut-il être chauffé ? Exploitez la chaleur inerte pour la précision et la sécurité



















