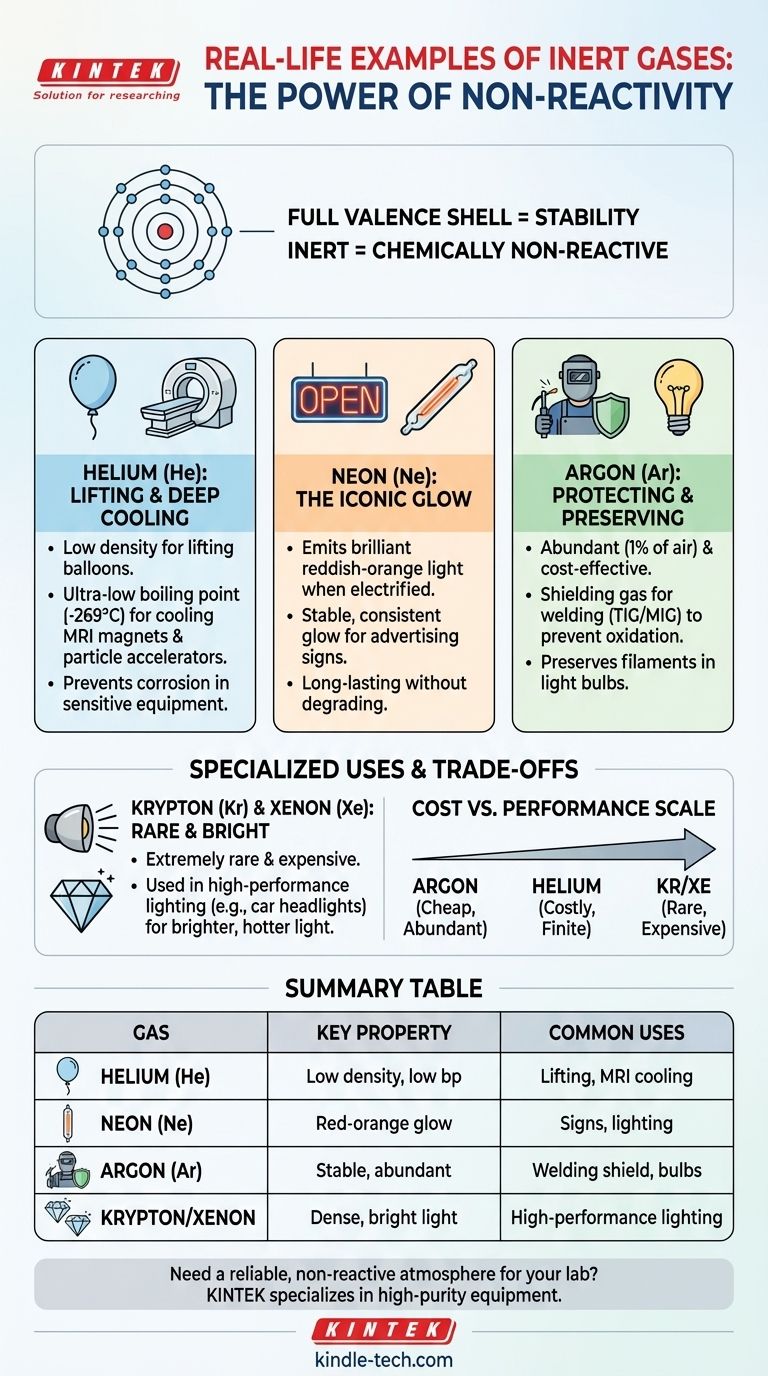
En bref, les gaz inertes sont utilisés chaque fois qu'une atmosphère non réactive est nécessaire. Les exemples les plus courants dans le monde réel comprennent l'hélium pour gonfler les ballons et refroidir les aimants d'IRM, le néon pour créer des enseignes publicitaires éclatantes, et l'argon pour protéger le métal pendant le soudage et préserver le filament des ampoules à incandescence traditionnelles.
La véritable valeur d'un gaz inerte n'est pas ce qu'il fait, mais ce qu'il ne fait pas. Sa stabilité chimique est sa caractéristique déterminante, utilisée pour créer des environnements contrôlés exempts des réactions chimiques indésirables — comme l'oxydation et la combustion — qui se produiraient autrement.

Qu'est-ce qui rend un gaz « inerte » ?
Le terme « inerte » décrit une substance chimiquement non réactive. En chimie, cette propriété est incarnée de manière plus célèbre par les gaz nobles trouvés dans le groupe 18 du tableau périodique.
Le secret réside dans une couche externe complète
La stabilité des gaz nobles tient à leur structure atomique. Ils possèdent une couche externe complète d'électrons, connue sous le nom de couche de valence.
Cette couche complète signifie qu'ils ont peu ou pas de tendance à gagner, perdre ou partager des électrons avec d'autres éléments. Ce manque fondamental d'ambition chimique est ce qui les rend si stables et prévisibles.
Un spectre d'« inertie »
Bien que nous les appelions inertes, leur réactivité existe sur un spectre. L'hélium (He) et le néon (Ne) sont extrêmement non réactifs.
Cependant, les gaz nobles plus lourds comme le Krypton (Kr), le Xénon (Xe) et le Radon (Rn) peuvent être forcés de former des composés chimiques dans des conditions de laboratoire très spécifiques. Cependant, à des fins industrielles et commerciales pratiques, ils sont traités comme inertes.
Exemples clés dans la technologie et l'industrie
La non-réactivité de ces gaz en fait des outils indispensables pour résoudre des défis d'ingénierie spécifiques.
Hélium (He) : Levage et refroidissement profond
L'hélium est l'élément le plus léger après l'hydrogène. Parce qu'il est beaucoup moins dense que l'air, son utilisation la plus célèbre est pour gonfler les ballons météorologiques, les ballons scientifiques et les ballons de fête.
Son application technique la plus critique est cependant celle de réfrigérant liquide. L'hélium liquide a un point d'ébullition incroyablement bas (−269 °C / −452 °F), ce qui en fait le réfrigérant ultime pour refroidir les aimants supraconducteurs dans les appareils d'IRM et les accélérateurs de particules comme le Grand collisionneur de hadrons. Son inertie garantit qu'il ne réagira pas avec l'équipement sensible et ne le corrodera pas.
Néon (Ne) : La lueur emblématique
Lorsqu'un courant électrique à haute tension traverse du gaz néon scellé dans un tube de verre, il émet une lumière rouge-orangée brillante et stable. C'est le principe derrière les enseignes emblématiques « néon ».
Bien que d'autres gaz produisent des couleurs différentes (l'argon pour le bleu, par exemple), le nom néon est devenu synonyme de ce type d'éclairage. Son inertie est essentielle, car elle permet au gaz de briller de manière constante pendant des milliers d'heures sans se dégrader.
Argon (Ar) : Protection et préservation
L'argon est le cheval de bataille des gaz inertes car il représente près de 1 % de l'atmosphère terrestre, ce qui le rend abondant et peu coûteux.
Son utilisation la plus courante est comme gaz de protection dans le soudage (comme le soudage TIG et MIG). Il est pompé sur la zone de soudure pour déplacer l'oxygène et la vapeur d'eau, ce qui empêche l'oxydation et donne un cordon de soudure beaucoup plus solide et propre. Le même principe est utilisé dans les ampoules à incandescence, où l'argon remplit l'ampoule pour empêcher le filament de tungstène chaud de griller.
Comprendre les compromis : coût par rapport à performance
Le choix du gaz inerte à utiliser dépend presque toujours de l'équilibre entre les exigences de performance et le coût.
L'abondance dicte le prix
L'argon est bon marché car il peut être facilement et économiquement séparé de l'air.
L'hélium est plus cher. Bien qu'il s'agisse du deuxième élément le plus abondant de l'univers, sur Terre, c'est une ressource finie, piégée sous terre et extraite avec le gaz naturel.
Le Krypton et le Xénon sont exceptionnellement rares dans l'atmosphère et très difficiles à isoler, ce qui les rend extrêmement coûteux.
Adapter le gaz à l'objectif
Vous utilisez de l'argon pour le soudage car il offre une excellente protection à faible coût.
Vous pourriez passer à un mélange hélium/argon plus coûteux uniquement pour le soudage spécialisé sur des métaux hautement conducteurs thermiquement comme le cuivre ou l'aluminium.
De même, vous utilisez du xénon coûteux dans les phares de voiture haute performance parce que sa densité et ses propriétés permettent à la lumière de brûler plus chaud et de manière beaucoup plus intense, justifiant le coût élevé pour une application premium.
Comment reconnaître le rôle d'un gaz inerte
Pour comprendre pourquoi un gaz inerte spécifique est utilisé, considérez l'objectif principal de l'application.
- Si l'objectif est de créer une atmosphère protectrice : Le gaz, souvent l'argon, est utilisé pour prévenir une réaction chimique indésirable telle que l'oxydation (par exemple, soudage, emballage alimentaire, préservation de documents historiques).
- Si l'objectif est l'éclairage spécialisé : Le choix (néon, argon, krypton ou xénon) est basé sur la couleur, la luminosité et l'efficacité souhaitées, le coût étant un facteur majeur dans la décision.
- Si l'objectif est le refroidissement extrême ou le levage : Les propriétés physiques uniques de l'hélium (point d'ébullition bas et faible densité) en font le seul choix pratique.
En fin de compte, ces gaz invisibles sont des facilitateurs essentiels, nous permettant d'accomplir des prouesses d'ingénierie et de science qui seraient impossibles dans notre monde réactif et riche en oxygène.
Tableau récapitulatif :
| Gaz inerte | Propriété clé | Utilisations courantes dans le monde réel |
|---|---|---|
| Hélium (He) | Faible densité, point d'ébullition extrêmement bas | Gonflage de ballons, refroidissement des aimants d'IRM |
| Néon (Ne) | Émet une lumière rouge-orangée lorsqu'il est électrifié | Enseignes publicitaires vibrantes, éclairage |
| Argon (Ar) | Chimiquement stable, abondant dans l'atmosphère | Gaz de protection pour le soudage, préservation des filaments d'ampoules |
| Krypton/Xénon | Dense, produit une lumière blanche intense | Éclairage haute performance (par exemple, phares de voiture) |
Besoin d'une atmosphère fiable et non réactive pour vos processus de laboratoire ? KINTEK se spécialise dans la fourniture d'équipements et de consommables de laboratoire de haute pureté pour répondre à vos besoins spécifiques. Que vous ayez besoin d'environnements contrôlés pour des expériences sensibles ou de fournitures fiables pour vos recherches, notre expertise garantit précision et qualité. Contactez notre équipe dès aujourd'hui pour discuter de la manière dont nous pouvons soutenir le succès de votre laboratoire !
Guide Visuel
Produits associés
- Four à atmosphère contrôlée de 1400℃ avec atmosphère d'azote et inerte
- Four à atmosphère contrôlée 1700℃ Four à atmosphère inerte d'azote
- Four à atmosphère contrôlée 1200℃ Four à atmosphère inerte d'azote
- Four rotatif continu scellé sous vide Four rotatif
- Four à atmosphère d'hydrogène contrôlée à l'azote
Les gens demandent aussi
- Quels sont les paramètres importants dans le dépôt de couches minces par pulvérisation cathodique magnétron ? Maîtrisez les propriétés de votre film.
- Pourquoi un nettoyeur à ultrasons haute fréquence est-il nécessaire pour la préparation des substrats en acier ? Obtenir une adhérence de revêtement de 100 %
- Pourquoi l'argon est-il utilisé dans la pulvérisation magnétron ? Découvrez le secret des films minces efficaces et de haute qualité
- Comment les congélateurs ULT améliorent-ils la durée de conservation des composants médicaux ? Prolongez la viabilité des échantillons pendant des années
- À quoi sert un évaporateur rotatif à reflux ? Élimination douce des solvants pour les composés sensibles à la chaleur
- Quelle est la différence entre l'extrait de cannabis et le distillat ? Un guide sur la puissance par rapport aux effets à spectre complet.
- Qu'est-ce que le processus de pulvérisation cathodique en AAS ? Un guide sur la technologie de dépôt de couches minces
- Quels sont les catalyseurs de la pyrolyse catalytique ? Découvrez la clé pour optimiser les rendements en biocarburants et produits chimiques



















