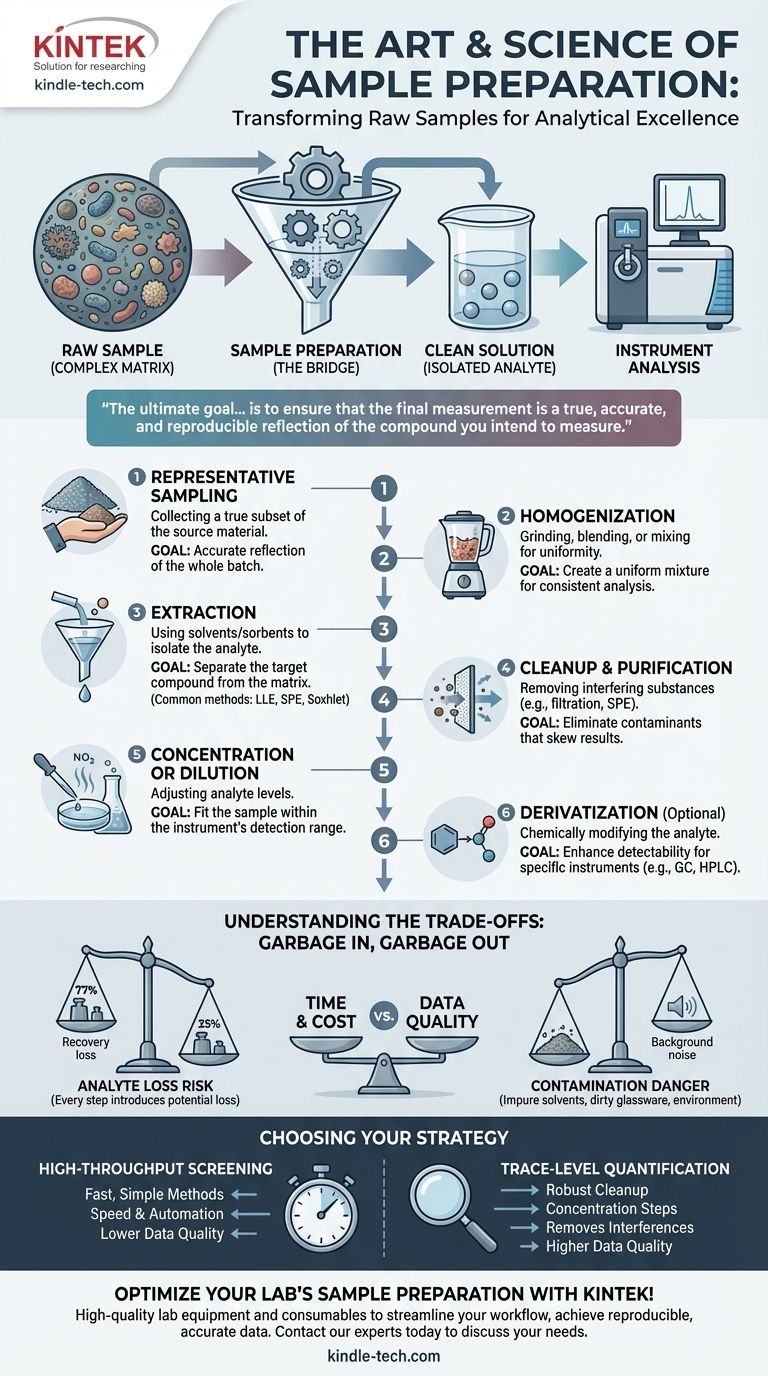
À la base, la préparation des échantillons est la série d'étapes que vous entreprenez pour transformer un échantillon brut et complexe en une solution propre et simple, adaptée à l'analyse par un instrument. Ce processus est sans doute l'étape la plus critique de toute analyse chimique. Les étapes les plus courantes comprennent l'échantillonnage représentatif, l'homogénéisation, l'extraction de l'analyte cible de la matrice de l'échantillon, le nettoyage pour éliminer les interférences, et enfin, la concentration ou la dilution pour s'adapter à la plage de détection de l'instrument.
L'objectif ultime de la préparation des échantillons n'est pas simplement de traiter un échantillon, mais de s'assurer que la mesure finale est un reflet fidèle, précis et reproductible du composé que vous avez l'intention de mesurer. Une mauvaise préparation des échantillons est la principale source d'erreur en chimie analytique, invalidant même l'analyse instrumentale la plus avancée.

L'objectif fondamental : de l'échantillon brut à l'analyte mesurable
Les échantillons bruts — qu'il s'agisse de sol, de sang, d'eau ou d'un produit alimentaire — sont des mélanges incroyablement complexes. Ces mélanges, connus sous le nom de matrice d'échantillon, contiennent des milliers de composés qui peuvent interférer avec la capacité d'un instrument à détecter le composé spécifique qui vous intéresse, connu sous le nom d'analyte.
La préparation des échantillons est le pont entre cet échantillon brut complexe et la solution propre que l'instrument exige. Son but est d'isoler l'analyte de la matrice, d'éliminer les substances interférentes et d'ajuster sa concentration à un niveau optimal pour la mesure.
Un aperçu étape par étape du flux de travail de préparation
Bien que la procédure exacte varie considérablement en fonction de l'échantillon et de la technique analytique, les principes sous-jacents suivent une progression logique.
Étape 1 : Échantillonnage représentatif
C'est l'étape la plus cruciale. Si l'échantillon initial collecté ne représente pas fidèlement l'ensemble du lot, du champ ou du patient, aucun travail de laboratoire, même le plus minutieux, ne pourra corriger l'erreur.
L'objectif est d'obtenir un petit échantillon gérable dont la composition est identique à celle du matériau source beaucoup plus grand. Cela peut impliquer de collecter des échantillons à plusieurs endroits et de les combiner (échantillonnage composite) ou d'utiliser des protocoles statistiques spécifiques.
Étape 2 : Homogénéisation
La plupart des échantillons bruts ne sont pas uniformes. Un échantillon de sol contient des cailloux et de la matière organique ; un échantillon de tissu contient différents types de cellules.
L'homogénéisation est le processus qui consiste à rendre l'échantillon uniforme, généralement par broyage, mélange ou trituration. Cela garantit que tout petit sous-échantillon (ou aliquote) prélevé pour analyse est véritablement représentatif de l'échantillon entier que vous avez collecté.
Étape 3 : Extraction (Libération de l'analyte)
L'extraction est le processus qui consiste à extraire l'analyte de la matrice d'échantillon solide ou liquide. Le choix de la technique dépend des propriétés physiques et chimiques de votre analyte et de la matrice.
Les méthodes courantes incluent :
- Extraction liquide-liquide (ELL) : Utilisation d'un solvant qui dissout préférentiellement l'analyte mais pas les composants de la matrice.
- Extraction en phase solide (SPE) : Passage d'un échantillon liquide à travers un sorbant solide qui retient soit l'analyte, soit les interférences.
- Extraction de Soxhlet : Lavage continu d'un échantillon solide avec un solvant chauffé pour extraire les analytes.
Étape 4 : Nettoyage et purification
L'extraction est rarement parfaite ; elle extrait souvent d'autres composés de la matrice qui peuvent interférer avec l'analyse. L'étape de nettoyage est conçue pour éliminer ces interférences.
Cette étape purifie davantage votre extrait d'échantillon. Les techniques peuvent être aussi simples que la filtration pour éliminer les particules ou aussi sophistiquées que l'utilisation d'une deuxième cartouche SPE différente pour éliminer sélectivement les composés indésirables.
Étape 5 : Concentration ou dilution
Les instruments analytiques ont une plage de concentration optimale pour la détection.
Si votre analyte est présent à de très faibles niveaux (analyse de traces), vous devrez concentrer l'échantillon. Cela se fait souvent en évaporant le solvant, généralement avec un léger courant d'azote.
Si l'analyte est à une très forte concentration, vous devez effectuer une dilution précise avec un solvant pur pour le ramener dans la plage linéaire de l'instrument et éviter de saturer le détecteur.
Étape 6 : Dérivatisation (si nécessaire)
Certains analytes sont difficiles à détecter sous leur forme naturelle. Ils peuvent ne pas être suffisamment volatils pour la chromatographie en phase gazeuse (CPG) ou manquer d'une caractéristique visible par un détecteur UV ou de fluorescence.
La dérivatisation est une réaction chimique qui convertit l'analyte en une forme plus "compatible avec l'instrument", le rendant plus volatil, thermiquement stable ou détectable.
Comprendre les compromis : le principe "Garbage In, Garbage Out" (déchets en entrée, déchets en sortie)
Chaque étape ajoutée à un flux de travail de préparation d'échantillons introduit des sources potentielles d'erreur. Un protocole réussi est souvent un compromis entre pureté et récupération.
Le risque de perte d'analyte
Chaque étape de transfert, de filtration ou d'extraction comporte le risque de perdre une partie de votre analyte cible. Une procédure en 10 étapes où vous perdez seulement 5 % de votre analyte à chaque étape aboutit à une récupération finale de seulement 60 %. Les méthodes plus simples sont souvent meilleures si elles répondent aux exigences analytiques.
Le danger de contamination
Inversement, chaque étape est une occasion d'introduire une contamination. Celle-ci peut provenir de solvants impurs, de verrerie sale, de pointes de pipette ou même de l'environnement du laboratoire. La contamination entraîne des résultats faussement élevés ou l'apparition de pics interférents dans vos données.
Temps et coût vs. qualité des données
La préparation des échantillons est fréquemment la partie la plus longue et la plus laborieuse d'une analyse. Il y a un compromis constant entre l'utilisation d'une méthode rapide et simple (par exemple, "diluer et injecter") et un protocole plus complexe et multi-étapes qui produit des données plus propres. Le bon choix dépend entièrement de votre objectif analytique.
Choisir la bonne stratégie de préparation
Votre stratégie de préparation des échantillons doit être directement alignée sur l'objectif de votre analyse.
- Si votre objectif principal est le criblage à haut débit : Privilégiez la rapidité et l'automatisation, en acceptant une qualité de données potentiellement inférieure. Des techniques comme le "diluer et injecter" ou la simple précipitation des protéines sont souvent suffisantes.
- Si votre objectif principal est la quantification à l'état de traces : Mettez l'accent sur des étapes de nettoyage et de concentration robustes pour éliminer les interférences de la matrice et amener votre analyte dans la plage de détection optimale de l'instrument.
- Si votre objectif principal est l'identification de composés inconnus : Utilisez les méthodes les plus douces possibles pour éviter d'altérer les analytes et minimisez les étapes pour réduire le risque d'introduire des artefacts du processus lui-même.
Investir du temps dans le développement et la validation d'un protocole de préparation d'échantillons robuste est l'étape la plus importante pour obtenir des résultats analytiques fiables et défendables.
Tableau récapitulatif :
| Étape | Action clé | Objectif principal |
|---|---|---|
| 1. Échantillonnage représentatif | Collecte d'un véritable sous-ensemble du matériau source | S'assurer que l'échantillon reflète fidèlement l'ensemble du lot ou de la source |
| 2. Homogénéisation | Broyage, mélange ou trituration de l'échantillon | Créer un mélange uniforme pour une analyse cohérente |
| 3. Extraction | Utilisation de solvants ou de sorbants pour isoler l'analyte | Séparer le composé cible de la matrice de l'échantillon |
| 4. Nettoyage/Purification | Élimination des substances interférentes (par ex. filtration, SPE) | Éliminer les contaminants qui pourraient fausser les résultats |
| 5. Concentration/Dilution | Ajustement des niveaux d'analyte (évaporation ou dilution) | Adapter l'échantillon à la plage de détection de l'instrument |
| 6. Dérivatisation (Facultatif) | Modification chimique de l'analyte | Améliorer la détectabilité pour des instruments spécifiques (par ex. CPG, CLHP) |
Optimisez la préparation des échantillons de votre laboratoire avec KINTEK !
Une mauvaise préparation des échantillons est la principale cause d'erreur analytique – ne laissez pas des résultats peu fiables compromettre votre travail. KINTEK est spécialisé dans les équipements et consommables de laboratoire de haute qualité conçus pour rationaliser votre flux de travail, de l'homogénéisation et l'extraction à la purification et la concentration. Que vous soyez axé sur le criblage à haut débit ou la quantification à l'état de traces, nos produits vous aident à obtenir des données reproductibles et précises.
Contactez nos experts dès aujourd'hui pour discuter de la manière dont KINTEK peut répondre aux besoins spécifiques de votre laboratoire et améliorer vos résultats analytiques.
Guide Visuel
Produits associés
- Homogénéisateur stérile à type de claquement pour le broyage et la dispersion de tissus
- Mini broyeur planétaire de laboratoire pour broyage
- Machine de moulage de spécimens métallographiques pour matériaux et analyses de laboratoire
- Tamis vibrant de laboratoire pour tamisage tridimensionnel sec et humide
- Meuleuse planétaire à haute énergie pour laboratoire de type réservoir horizontal
Les gens demandent aussi
- Quelles précautions de sécurité sont associées au fonctionnement d'une presse ? Assurer la sécurité de l'opérateur et prévenir les accidents
- Quel peut être le poids d'une presse hydraulique ? Des presses d'établi de 20 kg aux géants industriels de plus de 1000 tonnes
- Pourquoi les presses hydrauliques de laboratoire sont-elles essentielles pour évaluer les performances des géopolymères ? Assurer des tests de matériaux fiables
- Quel est le but de l'utilisation d'une presse hydraulique de laboratoire pour la poudre d'Al-LLZ ? Obtenir des corps verts de haute densité
- La pression hydraulique change-t-elle avec la température ? Comprendre le lien critique pour la sécurité du système
- Comment fabriquer des pastilles IR ? Un guide étape par étape pour une préparation impeccable d'échantillons FTIR
- Combien de types de presses hydrauliques existe-t-il ? Un guide des conceptions de châssis pour votre application
- Quelle est la taille d'une presse à forger ? Faites correspondre la tonne et l'empreinte aux besoins de votre forgeage