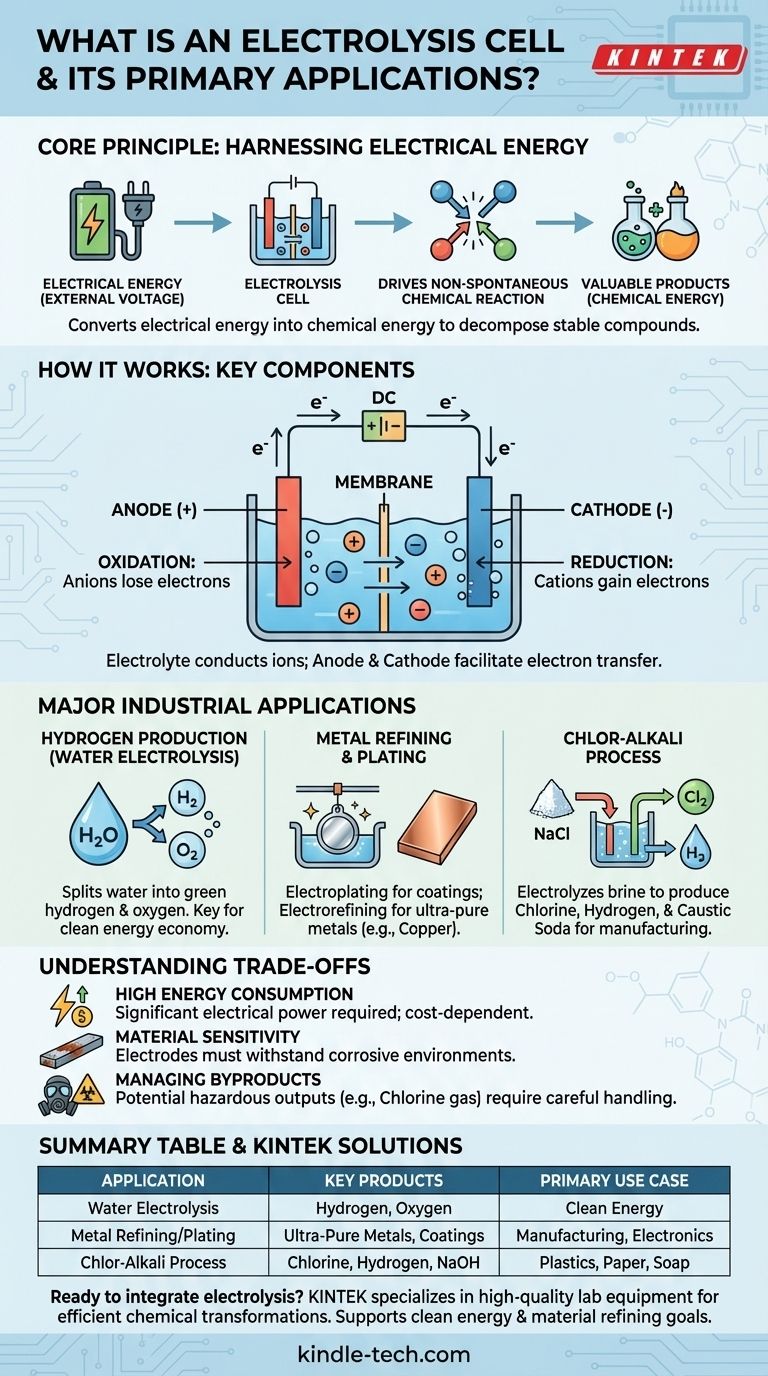
Essentiellement, une cellule d'électrolyse est un dispositif qui exploite l'énergie électrique pour provoquer une réaction chimique qui ne se produirait pas spontanément. Elle fonctionne en faisant passer un courant électrique à travers une substance, généralement une solution contenant des ions, pour la décomposer ou la transformer. Les applications industrielles clés comprennent la production d'hydrogène à partir de l'eau, l'affinage de métaux comme le cuivre et la fabrication de produits chimiques essentiels comme le chlore et l'hydroxyde de sodium.
Une cellule d'électrolyse convertit fondamentalement l'énergie électrique en énergie chimique. Elle surmonte la stabilité naturelle des composés, utilisant l'électricité comme un outil pour les décomposer et créer de nouvelles substances, souvent plus précieuses.

Comment fonctionne une cellule d'électrolyse
Une cellule d'électrolyse fonctionne sur le principe de l'électrolyse, ce qui signifie littéralement « décomposer par l'électricité ». Ce processus est l'opposé de ce qui se passe dans une batterie (une cellule galvanique), qui produit de l'électricité à partir d'une réaction chimique spontanée.
Le principe fondamental : forcer une réaction
De nombreux composés chimiques précieux, comme l'eau (H₂O) ou le sel (NaCl), sont très stables. Ils ne se décomposent pas spontanément en leurs éléments constitutifs.
Une cellule d'électrolyse fournit l'énergie nécessaire, sous forme de tension externe, pour forcer ces réactions non spontanées à se produire. Cet apport d'énergie surmonte les liaisons chimiques qui maintiennent le composé uni.
Composants clés
Chaque cellule d'électrolyse possède trois composants principaux :
- Anode : L'électrode positive. À l'anode, les ions chargés négativement (anions) perdent des électrons dans un processus appelé oxydation.
- Cathode : L'électrode négative. À la cathode, les ions chargés positivement (cations) gagnent des électrons dans un processus appelé réduction.
- Électrolyte : Une substance (souvent une solution) contenant des ions libres. L'électrolyte conduit l'électricité et fournit la matière première de la réaction.
Le type d'électrodes et l'électrolyte spécifique utilisé sont soigneusement choisis car ils déterminent directement les produits qui seront formés.
Principales applications industrielles
La capacité à contrôler précisément les transformations chimiques grâce à l'électricité fait de l'électrolyse une pierre angulaire de l'industrie moderne.
Production d'hydrogène à partir de l'eau
L'application la plus discutée aujourd'hui est peut-être l'électrolyse de l'eau. En faisant passer un courant dans l'eau (contenant un électrolyte approprié), la cellule sépare les molécules de H₂O en leurs composants.
Le gaz oxygène se forme à l'anode, tandis que le gaz hydrogène pur se forme à la cathode. Lorsque l'électricité utilisée provient de sources renouvelables, le produit résultant est appelé « hydrogène vert », un composant clé d'une future économie d'énergie propre.
Raffinage et placage des métaux
L'électrolyse est essentielle pour produire et purifier les métaux. Dans le placage électrolytique (ou galvanoplastie), un objet est placé comme cathode dans une cellule contenant des ions du métal de placage souhaité (comme le chrome ou le nickel). Les ions métalliques sont réduits sur l'objet, formant un revêtement mince et durable.
De même, l'électroraffinage est utilisé pour produire des métaux ultra-purs. Une plaque de cuivre impur, par exemple, est utilisée comme anode. Lorsque le courant est appliqué, les atomes de cuivre se dissolvent dans l'électrolyte, se déplacent vers la cathode et se redéposent sous forme de cuivre pur à près de 100 %, laissant les impuretés derrière eux.
Le procédé Chlore-Alcali
Ce processus industriel massif est l'une des utilisations les plus importantes de l'électrolyse. Une solution concentrée de chlorure de sodium (saumure) est électrolysée.
Il en résulte la production de trois produits chimiques de base très précieux à partir de simple eau salée : le gaz chlore, le gaz hydrogène et l'hydroxyde de sodium (soude caustique). Ce sont des ingrédients fondamentaux pour la fabrication de plastiques, de papier, de savons et de milliers d'autres produits.
Comprendre les compromis
Bien que puissante, l'électrolyse n'est pas une solution universelle. Son application implique des considérations importantes.
Consommation énergétique élevée
Le principal inconvénient de l'électrolyse est sa forte exigence énergétique. Forcer la décomposition d'un composé stable nécessite une quantité substantielle d'énergie électrique, ce qui peut rendre le processus coûteux. La viabilité économique d'un processus électrolytique est souvent directement liée au coût de l'électricité.
Sensibilité des matériaux et corrosion
Les électrodes elles-mêmes font partie d'un environnement chimique actif. Elles doivent être capables de résister à des conditions corrosives et à des températures élevées sans se dégrader ou réagir de manière indésirable. Le choix du bon matériau d'électrode est crucial pour l'efficacité et la longévité.
Gestion des sous-produits
L'électrolyse peut produire des sous-produits dangereux ou difficiles à manipuler. Par exemple, dans le procédé chlore-alcali, le gaz chlore produit est toxique et doit être géré avec une extrême prudence. L'impact environnemental global dépend fortement à la fois de la source d'électricité et de la manipulation sûre de tous les produits sortants.
Faire le bon choix pour votre objectif
La conception et le fonctionnement d'une cellule d'électrolyse sont adaptés spécifiquement à son objectif prévu.
- Si votre objectif principal est de produire des métaux de haute pureté : Votre processus se concentrera sur l'électroraffinage ou l'électro-extraction, où le contrôle précis de la tension et la pureté de l'électrolyte sont primordiaux pour garantir la qualité du produit.
- Si votre objectif principal est de générer des produits chimiques de base : Vous utiliserez probablement un modèle comme le procédé chlore-alcali, optimisé pour une production continue et à grande échelle à partir d'une matière première peu coûteuse comme la saumure.
- Si votre objectif principal est de créer des vecteurs d'énergie propre : Vos efforts impliqueront l'électrolyse de l'eau, où l'efficacité de la cellule et l'intégration avec des sources d'énergie renouvelable à faible coût sont les facteurs les plus critiques pour le succès.
En appliquant une énergie électrique ciblée, une cellule d'électrolyse transforme des intrants de base en produits de grande valeur, ce qui en fait un outil fondamental de la chimie et de l'industrie modernes.
Tableau récapitulatif :
| Application | Produits clés | Cas d'utilisation principal |
|---|---|---|
| Électrolyse de l'eau | Gaz hydrogène et oxygène | Énergie propre (Hydrogène vert) |
| Raffinage/Placage des métaux | Métaux ultra-purs, revêtements protecteurs | Fabrication, Électronique |
| Procédé Chlore-Alcali | Chlore, Hydrogène, Hydroxyde de sodium | Production de plastiques, papier, savon |
Prêt à intégrer la technologie d'électrolyse dans votre laboratoire ou votre processus industriel ? KINTEK est spécialisé dans les équipements de laboratoire et les consommables de haute qualité, fournissant les outils fiables dont vous avez besoin pour des transformations chimiques efficaces et précises. Que vous développiez des solutions d'énergie propre ou que vous affiniez des matériaux, notre expertise soutient vos objectifs. Contactez notre équipe dès aujourd'hui pour discuter de la manière dont nous pouvons améliorer vos opérations.
Guide Visuel
Produits associés
- Cellule électrochimique électrolytique à cinq ports
- Cellule électrolytique optique à double couche de type H avec bain-marie
- Cellule électrolytique de type H Triple Cellule électrochimique
- Cellule électrochimique électrolytique pour l'évaluation des revêtements
- Bain-marie électrolytique à cinq ports à double couche
Les gens demandent aussi
- Quelle est la bonne façon de manipuler une cellule électrolytique à bain-marie à cinq orifices ? Assurer des expériences électrochimiques précises et sûres
- Comment prévenir les fuites lors de l'utilisation d'une cellule électrolytique à cinq ports avec bain-marie ? Assurez une configuration électrochimique fiable et sûre
- Comment éviter la contamination lors des expériences avec la cellule électrolytique à bain-marie à cinq orifices ? Maîtrisez le Protocole des 3 Piliers
- De quel matériau est fabriquée la cellule électrolytique à cinq ports à bain-marie ? Verre borosilicaté et PTFE expliqués
- Quelle précaution générale doit être prise lors de la manipulation de la cellule électrolytique ? Assurer des résultats de laboratoire sûrs et précis



















