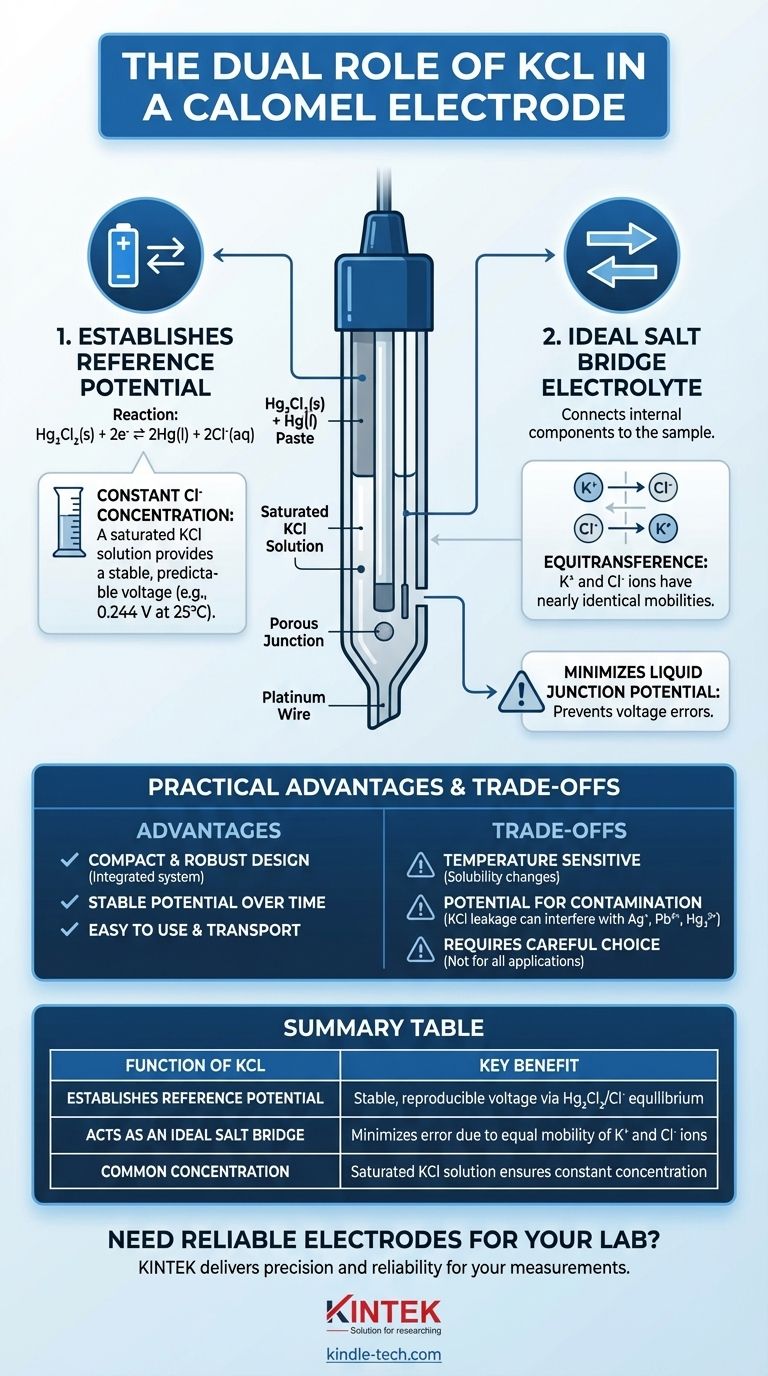
Essentiellement, le chlorure de potassium (KCl) est utilisé dans une électrode au calomel pour deux raisons cruciales. Premièrement, l'ion chlorure (Cl⁻) est un composant clé de la réaction chimique qui établit la tension stable de l'électrode. Deuxièmement, ses ions potassium (K⁺) et chlorure (Cl⁻) se déplacent à des vitesses presque identiques en solution, ce qui est la caractéristique déterminante d'un électrolyte de pont salin idéal.
La double fonction du KCl est la clé du succès de l'électrode au calomel. Ce n'est pas seulement un composant passif ; il participe activement à l'établissement du potentiel de référence tout en empêchant simultanément les erreurs de mesure en fonctionnant comme un pont salin très efficace.

Le double rôle du KCl dans le fonctionnement de l'électrode
Le choix du KCl est un choix d'ingénierie délibéré visant à créer une électrode de référence stable, reproductible et pratique. Il remplit deux objectifs distincts mais également importants.
Établir le potentiel de référence
La tension d'une électrode au calomel est générée par un équilibre chimique spécifique : Hg₂Cl₂(s) + 2e⁻ ⇌ 2Hg(l) + 2Cl⁻(aq).
Le potentiel de cette réaction dépend directement de la concentration des ions chlorure (Cl⁻) dans la solution. En remplissant l'électrode avec une solution de KCl de concentration connue et constante, un potentiel de référence stable et prévisible est établi.
Le plus souvent, une solution de KCl saturée est utilisée. Cela garantit que la concentration reste constante même si une partie de l'eau s'évapore, fournissant une tension hautement reproductible qui en fait une référence fiable pour les mesures électrochimiques.
Fonctionner comme un pont salin idéal
La solution de KCl agit également comme un pont salin, reliant les composants internes de l'électrode de référence à la solution échantillon que vous mesurez.
Un pont salin efficace nécessite que ses ions positifs et négatifs migrent dans la solution à des vitesses presque égales. Cette propriété est connue sous le nom d'équitransfert.
Si un ion se déplace beaucoup plus rapidement que l'autre, une séparation de charge s'accumule à la frontière entre les deux solutions. Cela crée une tension indésirable appelée potentiel de jonction liquide, qui introduit une erreur significative dans votre mesure.
Les mobilités des ions K⁺ et Cl⁻ sont presque identiques, ce qui minimise ce potentiel de jonction et assure l'exactitude de la mesure.
Avantages pratiques et compromis
L'utilisation du KCl apporte des avantages pratiques significatifs mais introduit également des considérations que chaque analyste doit comprendre.
Pourquoi le KCl est pratique
La nature intégrée du KCl — servant à la fois à la réaction de l'électrode et au pont salin — permet une conception compacte et robuste.
Une électrode au calomel ne nécessite pas de pont salin externe séparé. Cela la rend plus facile à installer, à utiliser et à transporter par rapport à d'autres systèmes de référence. Son potentiel est également connu pour être très stable dans le temps.
L'impact de la concentration
Le potentiel de l'électrode au calomel dépend entièrement de la concentration en KCl. Bien que le KCl saturé soit le plus courant, d'autres concentrations comme 1 M ou 0,1 M sont également utilisées pour des applications spécifiques.
L'utilisation d'une solution saturée est pratique car la concentration s'autorégule, mais cela signifie également que le potentiel de l'électrode est plus sensible aux changements de température, car la solubilité du KCl varie avec la température.
Potentiel de contamination
Un compromis critique est que la solution de remplissage de l'électrode peut fuir lentement dans l'échantillon par la jonction poreuse.
Si votre analyse implique des ions qui précipitent avec le chlorure, tels que l'argent (Ag⁺), le plomb (Pb²⁺) ou le mercure (Hg₂²⁺), la fuite de KCl peut provoquer des interférences et des résultats inexacts.
Faire le bon choix pour votre objectif
Comprendre le rôle du KCl vous aide à déterminer quand une électrode au calomel est l'outil approprié pour votre mesure électrochimique spécifique.
- Si votre objectif principal est la reproductibilité et la facilité d'utilisation : Une électrode au calomel saturée (ECS) est un excellent choix classique, à condition que votre échantillon soit exempt d'ions interférents et que la température soit stable.
- Si votre objectif principal est de minimiser la contamination par les chlorures : Vous devez utiliser un système de référence différent, tel qu'une électrode au mercure-sulfate mercureux, qui utilise un électrolyte sans chlorure.
- Si votre objectif principal est la performance dans des températures variables : Une électrode avec une solution de KCl non saturée (par exemple, 3 M) offre un potentiel plus stable face aux changements de température qu'une version saturée.
En fin de compte, le choix du KCl est fondamental dans la conception de l'électrode au calomel, fournissant la base stable requise pour des mesures précises et fiables.
Tableau récapitulatif :
| Fonction du KCl | Avantage clé |
|---|---|
| Établit le potentiel de référence | Fournit une tension stable et reproductible via l'équilibre Hg₂Cl₂/Cl⁻. |
| Agit comme un pont salin idéal | Minimise l'erreur de mesure grâce à la mobilité presque égale des ions K⁺ et Cl⁻. |
| Concentration courante | La solution de KCl saturée assure que la concentration reste constante, améliorant la reproductibilité. |
Besoin d'une électrode de référence fiable pour l'analyse électrochimique de votre laboratoire ?
Chez KINTEK, nous comprenons que la précision de vos mesures dépend d'équipements de laboratoire de haute qualité. Notre gamme d'électrodes et de consommables est conçue pour offrir la précision et la fiabilité dont votre laboratoire a besoin.
Laissez nos experts vous aider à choisir l'équipement parfait pour votre application spécifique. Contactez KINTEK dès aujourd'hui pour discuter de vos besoins et assurer le succès de votre laboratoire !
Guide Visuel
Produits associés
- Électrode de référence au calomel, chlorure d'argent, sulfate de mercure pour usage en laboratoire
- Électrode à disque de platine rotatif pour applications électrochimiques
- Électrode électrochimique à disque métallique
- Électrode en feuille de platine pour applications de laboratoire et industrielles
- Électrode à disque d'or
Les gens demandent aussi
- Quelles précautions doivent être prises concernant la profondeur d'insertion d'une électrode en fil de platine ? Assurer des mesures électrochimiques précises
- Quelles opérations doivent être effectuées sur une électrode en titane avant utilisation ? Assurer la sécurité et maximiser les performances
- Quels sont les avantages du treillis/mousse de nickel pour les électrodes HER ? Augmentation de la charge catalytique et de la gestion des gaz
- Comment entretenir les électrodes ? Un guide pour garantir des mesures précises et une longue durée de vie
- À quoi sert une électrode de platine ? Un guide sur sa stabilité et son pouvoir catalytique
- Pourquoi le fil de platine est-il utilisé comme électrode quasi-référence (QRE) dans le DMF ? Optimisez la précision en électrochimie non aqueuse
- Quelle est la fonction d'une électrode à brosse en fibre de carbone dans un EMBR ? Augmenter l'élimination de la DCO et la longévité de la membrane
- Quelle est la différence entre les électrodes en or et en argent ? Choisissez l'électrode adaptée à votre application