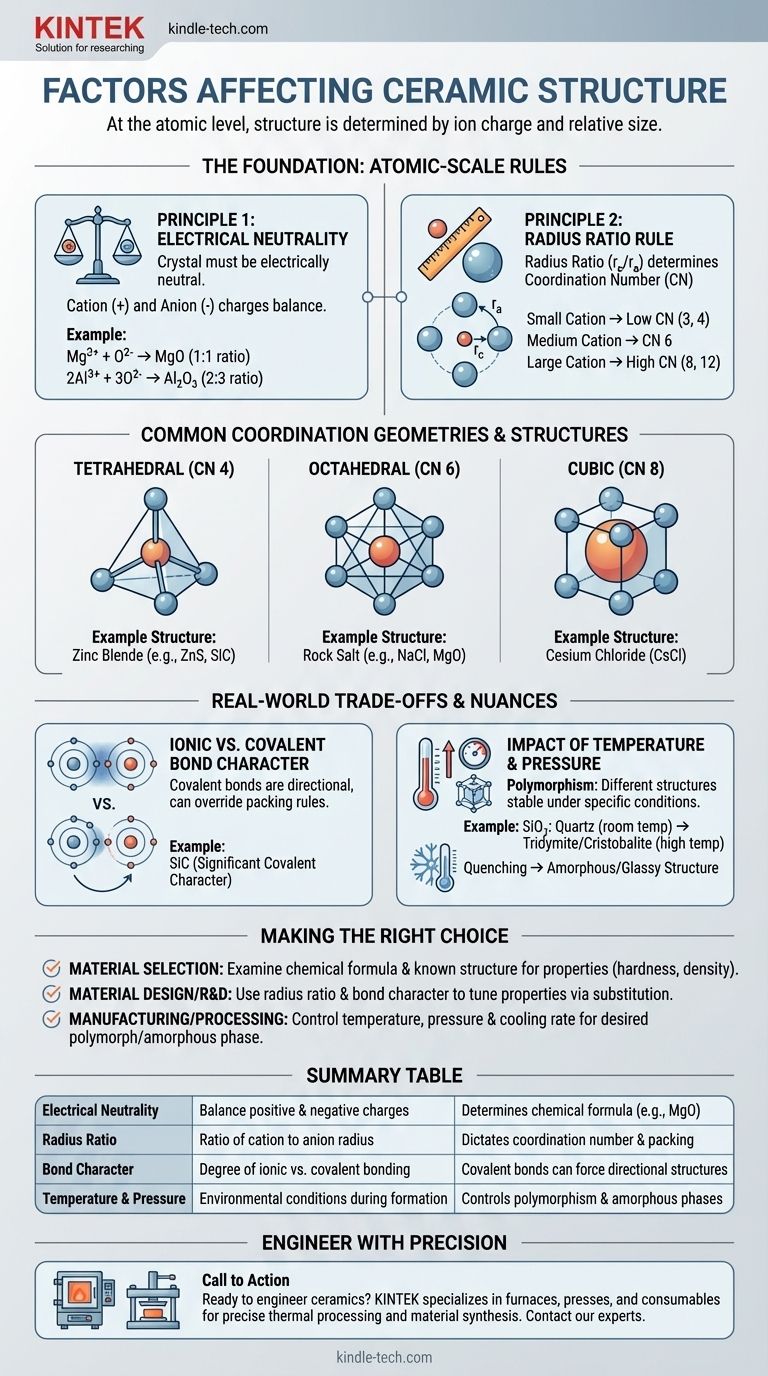
Au niveau atomique, la structure cristalline d'une céramique est déterminée par deux facteurs principaux : la charge électrique de ses ions constitutifs et la taille relative de ces ions. Pour former une structure stable et de faible énergie, l'arrangement des atomes doit satisfaire la neutralité de charge tout en s'assemblant de la manière la plus géométriquement efficace possible.
Le défi fondamental dans la formation de toute structure cristalline céramique est d'équilibrer des forces concurrentes. Les cations et les anions s'attirent, créant des structures denses, mais leurs tailles relatives dictent l'arrangement géométrique spécifique – le nombre de coordination – qui peut être physiquement atteint tout en maintenant la neutralité électrique globale.
Les Fondements : Règles à l'Échelle Atomique
Pour comprendre pourquoi une céramique comme l'oxyde de magnésium (MgO) forme une structure tandis que le carbure de silicium (SiC) en forme une autre, nous devons commencer par les deux règles non négociables qui régissent la manière dont les atomes s'organisent en un réseau cristallin stable.
Principe 1 : La Règle de la Neutralité Électrique
L'exigence la plus fondamentale est que le cristal doit être électriquement neutre. La somme de toutes les charges positives des cations doit être précisément équilibrée par la somme de toutes les charges négatives des anions.
Ce principe dicte la formule chimique elle-même. Par exemple, puisqu'un ion magnésium a une charge de +2 (Mg²⁺) et un ion oxygène a une charge de -2 (O²⁻), ils se combinent dans un rapport 1:1 pour former du MgO. Un ion aluminium (Al³⁺) et un ion oxygène (O²⁻) doivent se combiner dans un rapport 2:3 pour former de l'Al₂O₃ afin d'atteindre la neutralité.
Principe 2 : La Règle du Rapport des Rayons
Une fois la formule chimique établie, la géométrie prend le relais. Le rapport des rayons – le rayon du cation (r_c) divisé par le rayon de l'anion (r_a) – est le facteur critique qui détermine le nombre de coordination (NC).
Le nombre de coordination est simplement le nombre d'anions qui peuvent s'agencer autour d'un cation central. Imaginez que vous essayez d'emballer des ballons de basket (anions) autour d'une balle de tennis plus petite (cation). Vous ne pouvez en placer que quelques-uns avant qu'ils ne commencent à se toucher. Si vous remplacez la balle de tennis par un ballon de football plus grand, vous pouvez placer plus de ballons de basket autour. La taille relative dicte la géométrie d'empilement.
De l'Empilement Atomique à la Structure Cristalline
Ces deux principes agissent ensemble pour produire les motifs répétitifs et tridimensionnels qui définissent les structures cristallines des céramiques. Le rapport des rayons prédit le nombre de coordination, et la nécessité de la neutralité de charge dicte ensuite comment ces unités coordonnées se lient dans l'espace.
Géométries de Coordination Courantes
Des plages spécifiques de rapport des rayons suggèrent fortement un nombre de coordination préféré et sa forme correspondante :
- Un petit cation entraîne un faible NC, comme 3 (triangulaire) ou 4 (tétraédrique).
- Un cation de taille moyenne permet un NC de 6 (octaédrique).
- Un grand cation, presque de la taille de l'anion, peut atteindre un NC de 8 (cubique) ou même 12.
Exemples de Structures Céramiques Courantes
Ces règles donnent naissance à des structures cristallines bien connues, nommées d'après des minéraux courants. Pour les céramiques de type AX simples (un cation, un anion) :
- Structure de type sel gemme (par exemple, NaCl, MgO) : Caractérisée par un nombre de coordination de 6 pour le cation et l'anion. C'est une structure très stable et courante lorsque le cation et l'anion ont une différence de taille modérée.
- Structure de type chlorure de césium (CsCl) : Se produit lorsque le cation est presque aussi grand que l'anion, permettant un nombre de coordination de 8 plus étroitement compacté.
- Structure de type blende de zinc (par exemple, ZnS, SiC) : Se forme lorsque le cation est significativement plus petit que l'anion, résultant en un nombre de coordination de 4 (tétraédrique). Cette structure est également caractéristique des matériaux à forte liaison covalente.
Pour des formules plus complexes comme AₘXₚ (par exemple, Al₂O₃, CaF₂), les mêmes principes s'appliquent. La structure devient simplement un arrangement plus complexe pour garantir que chaque ion atteigne sa coordination préférée et que la charge globale reste neutre.
Comprendre les Compromis et les Limitations
Bien que ces principes fournissent un cadre puissant, ils constituent un modèle simplifié. Des facteurs du monde réel introduisent des nuances importantes qui peuvent altérer la structure finale.
Le Caractère de la Liaison Ionique vs. Covalente
La règle du rapport des rayons fonctionne mieux pour les liaisons purement ioniques. Cependant, de nombreuses céramiques, comme le carbure de silicium (SiC) et le nitrure de silicium (Si₃N₄), ont un caractère covalent significatif.
Les liaisons covalentes sont très directionnelles. Les atomes préfèrent se lier à des angles spécifiques (par exemple, 109,5° dans un tétraèdre). Dans ces matériaux, la nécessité de satisfaire les liaisons covalentes directionnelles peut l'emporter sur les règles d'empilement géométrique du rapport des rayons, forçant une structure spécifique comme la coordination tétraédrique.
L'Impact de la Température et de la Pression
Un seul composé chimique peut souvent exister sous plusieurs structures cristallines différentes, un phénomène connu sous le nom de polymorphisme. Chacune de ces structures, ou polymorphes, est stable sous une plage spécifique de température et de pression.
Par exemple, la silice (SiO₂) existe sous forme de quartz à température ambiante, mais se transforme en d'autres polymorphes comme la tridymite et la cristobalite à des températures plus élevées. Ces transformations impliquent un réarrangement des atomes en une nouvelle structure plus stable pour ces conditions.
De plus, si une céramique fondue est refroidie très rapidement (trempe), les atomes peuvent ne pas avoir suffisamment de temps pour s'organiser en un réseau cristallin ordonné. Cela entraîne une structure désordonnée, amorphe ou vitreuse.
Faire le Bon Choix pour Votre Application
Comprendre ces facteurs vous permet de relier le traitement et la composition d'une céramique à sa structure finale et, en fin de compte, à ses performances.
- Si votre objectif principal est la sélection de matériaux : Commencez par examiner la formule chimique et la structure cristalline connue. Une structure dense et à haute coordination comme le corindon (Al₂O₃) implique une dureté et une densité élevées, tandis qu'une structure à coordination plus faible peut avoir des propriétés différentes.
- Si votre objectif principal est la conception de matériaux ou la R&D : Utilisez le rapport des rayons et le caractère de liaison comme outils. La substitution d'atomes de tailles ou d'électronégativités différentes peut être utilisée pour modifier intentionnellement la structure cristalline et ajuster ses propriétés.
- Si votre objectif principal est la fabrication et le traitement : Vos variables clés sont la température, la pression et le taux de refroidissement. Utilisez-les pour contrôler quel polymorphe se forme ou pour choisir entre un produit final cristallin et amorphe.
En saisissant l'interaction de la charge, de la taille et des conditions de traitement, vous pouvez passer de la simple utilisation des céramiques à leur ingénierie délibérée pour un usage spécifique.
Tableau Récapitulatif :
| Facteur | Description | Impact Clé sur la Structure |
|---|---|---|
| Neutralité Électrique | Les charges positives et négatives totales dans le cristal doivent s'équilibrer. | Détermine la formule chimique (par exemple, MgO, Al₂O₃). |
| Rapport des Rayons | Le rapport du rayon du cation au rayon de l'anion (r_c/r_a). | Dicte le nombre de coordination et la géométrie d'empilement (par exemple, tétraédrique, octaédrique). |
| Caractère de Liaison | Le degré de liaison ionique vs. covalente. | Les liaisons covalentes peuvent forcer des structures directionnelles, outrepassant les règles d'empilement simples. |
| Température & Pression | Les conditions environnementales pendant la formation et le traitement. | Contrôle le polymorphisme (différentes formes cristallines) et la formation de phases amorphes/vitreuses. |
Prêt à concevoir des céramiques avec précision ? Le bon équipement de laboratoire est essentiel pour contrôler les facteurs qui définissent la structure et les performances de votre matériau. KINTEK est spécialisé dans les fours, les presses et les consommables dont votre laboratoire a besoin pour un traitement thermique et une synthèse de matériaux précis. Contactez nos experts dès aujourd'hui pour discuter de la manière dont nos solutions peuvent vous aider à atteindre vos objectifs matériels spécifiques.
Guide Visuel
Produits associés
- Plaque céramique carbure de silicium (SiC) ingénierie résistante à l'usure céramiques fines avancées
- Plaque de céramique de nitrure de silicium usinée avec précision (SiN) pour la fabrication de céramiques fines avancées
- Tamis de laboratoire et machines de tamisage
- Bille en céramique de zircone usinée avec précision pour la céramique fine avancée d'ingénierie
- Dissipateur thermique en alumine Al2O3 céramique avancée pour isolation
Les gens demandent aussi
- Quelle est la température de frittage des membranes céramiques ? Un guide de 750°C à 2100°C+
- Existe-t-il des inconvénients aux céramiques ? Le compromis entre dureté et fragilité
- Que fait la fibre céramique ? Obtenez une isolation et un contrôle supérieurs à haute température
- Quelle est la température d'utilisation maximale de l'alumine ? Libérez des performances thermiques élevées pour votre laboratoire
- Quels sont les rôles des additifs de frittage ? Maîtrisez le processus pour des performances matérielles supérieures
- Que se passe-t-il lorsque la céramique est chauffée ? Une plongée en profondeur dans la chaleur radiante et la stabilité thermique
- Quel est le but de l'utilisation de l'isolation en fibre céramique dans les pipelines de sel fondu ? Assurer la fluidité et l'efficacité énergétique
- Existe-t-il une alternative à la couronne en porcelaine ? Découvrez vos meilleures options pour la force et l'esthétique



















