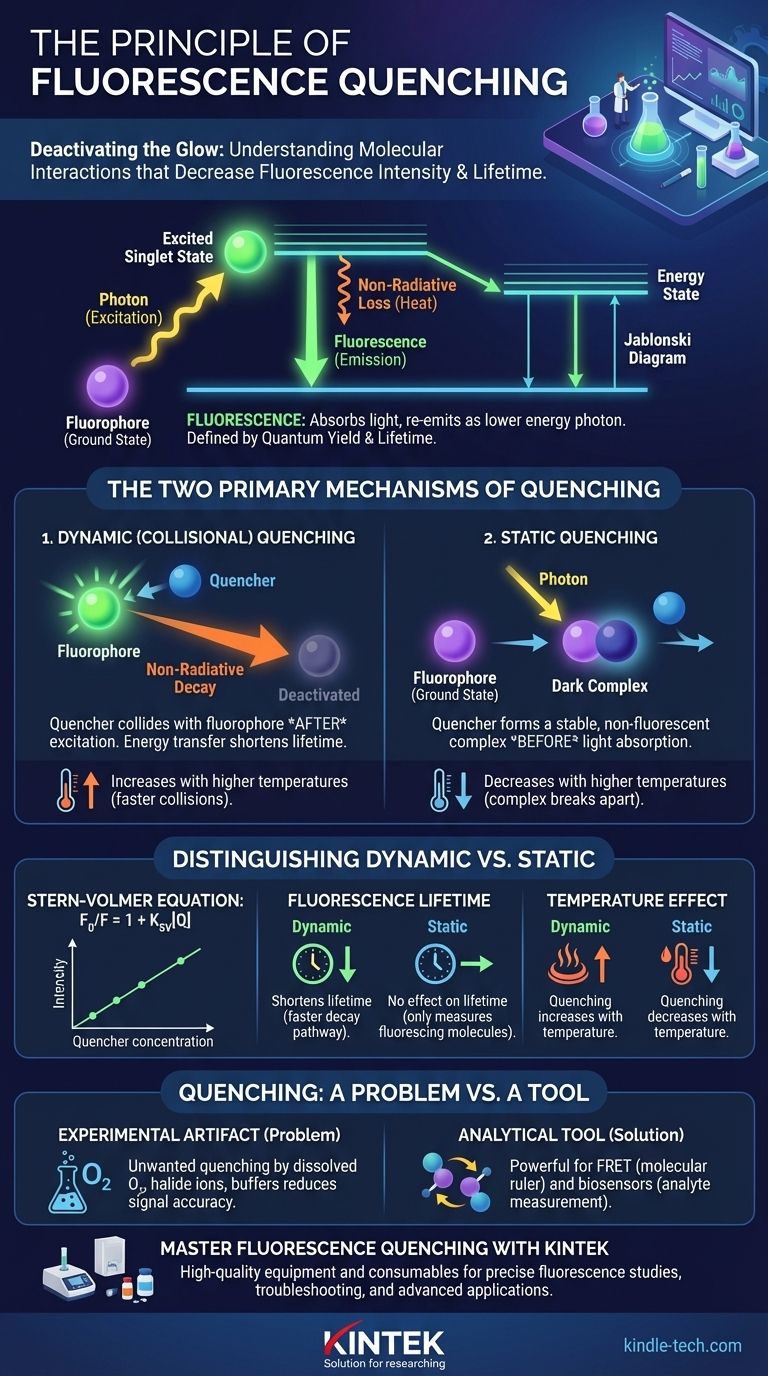
Essentiellement, l'effet d'extinction est tout processus qui diminue l'intensité et/ou la durée de vie de la fluorescence d'une substance donnée. Cela se produit lorsqu'un fluorophore excité — une molécule capable d'absorber et de réémettre de la lumière — est désactivé par une interaction avec une autre molécule, connue sous le nom d'extincteur. Au lieu de libérer son énergie absorbée sous forme de photon lumineux, le fluorophore retourne à son état fondamental par une voie non radiative, atténuant ou éteignant efficacement sa lueur.
Le principe fondamental est que l'extinction ne consiste pas simplement à atténuer un signal ; il s'agit d'une interaction moléculaire spécifique. Comprendre si cette interaction se produit avant ou après l'absorption de la lumière est la clé pour distinguer ses principaux types et décider si l'extinction est un problème expérimental à résoudre ou un outil analytique puissant à exploiter.

Le fondement : comment fonctionne la fluorescence
Pour saisir l'extinction, il faut d'abord comprendre son opposé : la fluorescence. Ce phénomène est un processus en plusieurs étapes régi par les états énergétiques d'une molécule.
Le diagramme de Jablonski en bref
Un diagramme de Jablonski simplifié aide à visualiser le processus. Premièrement, un fluorophore absorbe un photon de lumière, faisant passer un électron à un état singulet excité de plus haute énergie.
Cet état excité est instable. La molécule perd rapidement une petite quantité d'énergie sous forme de chaleur ou de vibration avant d'émettre l'énergie restante sous forme de photon de plus basse énergie (longueur d'onde plus longue), que nous percevons comme de la fluorescence.
Durée de vie de la fluorescence et rendement quantique
Deux propriétés définissent l'émission d'un fluorophore. Le rendement quantique est l'efficacité de ce processus — le rapport entre les photons émis et les photons absorbés. La durée de vie de la fluorescence est le temps moyen que le fluorophore passe dans l'état excité avant de revenir à l'état fondamental, généralement de l'ordre des nanosecondes. L'extinction réduit directement ces deux valeurs.
Les deux principaux mécanismes d'extinction
L'interaction entre un fluorophore et un extincteur peut se produire de deux manières fondamentalement différentes, qui présentent des signatures expérimentales distinctes.
Extinction dynamique (collisionnelle)
L'extinction dynamique se produit lorsqu'une molécule extinctrice entre en collision avec un fluorophore après qu'il ait déjà été excité par la lumière. Au cours de cette collision, l'énergie est transférée du fluorophore à l'extincteur.
Ce contact fournit une voie externe et non radiative au fluorophore excité pour revenir à son état fondamental. Parce qu'elle dépend de collisions aléatoires, ce processus est fortement influencé par des facteurs tels que la température et la viscosité qui affectent la diffusion moléculaire.
Extinction statique
L'extinction statique se produit lorsqu'une molécule extinctrice forme un complexe stable et non fluorescent avec un fluorophore avant que l'absorption de la lumière ne se produise. Ce complexe à l'état fondamental est effectivement « sombre ».
Lorsque ce complexe absorbe un photon, il retourne immédiatement à l'état fondamental sans émettre de lumière. La diminution observée de la fluorescence provient du fait qu'une fraction des fluorophores était déjà liée et incapable de fluorescer en premier lieu.
Différencier l'extinction dynamique de l'extinction statique
Pour toute expérience, déterminer le type d'extinction est crucial. Heureusement, ils ont des effets différents sur les propriétés du fluorophore.
L'équation de Stern-Volmer
La relation entre l'intensité de la fluorescence et la concentration de l'extincteur est décrite par l'équation de Stern-Volmer : F₀/F = 1 + Kₛᵥ[Q].
Ici, F₀ est l'intensité de fluorescence sans extincteur, F est l'intensité avec un extincteur, [Q] est la concentration de l'extincteur, et Kₛᵥ est la constante d'extinction de Stern-Volmer. Un graphique linéaire de F₀/F en fonction de [Q] est indicatif d'un seul mécanisme d'extinction.
L'impact sur la durée de vie de la fluorescence
C'est le test décisif. L'extinction dynamique raccourcit la durée de vie de la fluorescence mesurée car elle introduit une voie plus rapide pour que le fluorophore excité revienne à l'état fondamental.
Inversement, l'extinction statique n'a aucun effet sur la durée de vie de la fluorescence. Les fluorophores qui ne font pas partie du complexe à l'état fondamental fluoresce normalement, et les molécules « éteintes » n'ont jamais été excitées au départ. La mesure de la durée de vie ne capture que le signal des molécules qui sont encore capables de fluorescer.
L'effet de la température
La température est un autre outil de diagnostic puissant. Étant donné que l'extinction dynamique repose sur des collisions, son taux augmente avec des températures plus élevées, ce qui provoque un mouvement et une diffusion plus rapides des molécules.
L'extinction statique, cependant, repose sur un complexe stable. Des températures plus élevées fournissent souvent suffisamment d'énergie pour rompre ce complexe, diminuant ainsi la quantité d'extinction statique.
L'extinction : un problème ou un outil
L'extinction est une arme à double tranchant dans la recherche scientifique. Selon le contexte, elle peut être une source frustrante d'erreur ou une technique de mesure très précise.
L'extinction comme artefact expérimental
L'extinction indésirable est un problème courant. Les coupables fréquents dans les échantillons biologiques comprennent l'oxygène dissous, les ions halogénures (comme Cl⁻ ou I⁻) et certains composants tampons. Cela peut entraîner une réduction du rapport signal/bruit et des mesures inexactes.
L'extinction comme outil analytique
Lorsqu'elle est contrôlée, l'extinction est incroyablement puissante. Le Transfert d'Énergie par Résonance de Förster (FRET) est un type spécial d'extinction où l'énergie est transférée entre deux fluorophores différents, permettant aux chercheurs de mesurer les distances moléculaires à l'échelle nanométrique.
De plus, les biocapteurs basés sur l'extinction sont conçus de telle sorte que la présence d'un analyte spécifique (comme le glucose ou l'oxygène) éteint un signal fluorescent. Le degré d'extinction devient une lecture directe de la concentration de l'analyte.
Appliquer ces connaissances à votre expérience
Votre approche de l'extinction dépend entièrement de votre objectif expérimental.
- Si votre objectif principal est de maximiser un signal fluorescent : Examinez attentivement vos solutions à la recherche d'extincteurs courants (par exemple, l'acrylamide, l'iodure, l'O₂ dissous) et envisagez de dégazéifier les échantillons ou d'utiliser différents tampons.
- Si votre objectif principal est de mesurer la concentration d'un analyte : Concevez un système où votre analyte cible est l'extincteur, vous permettant de calculer sa concentration en mesurant la baisse prévisible de la fluorescence.
- Si votre objectif principal est d'étudier les interactions moléculaires : Utilisez des techniques d'extinction contrôlée comme le FRET, où l'extinction d'un fluorophore « donneur » par un « accepteur » fournit une mesure directe de leur proximité.
En comprenant les principes de l'extinction, vous la transformez d'un obstacle potentiel en un instrument précis pour l'investigation moléculaire.
Tableau récapitulatif :
| Type d'extinction | Mécanisme | Effet sur la durée de vie | Dépendance à la température |
|---|---|---|---|
| Dynamique (Collisionnelle) | L'extincteur entre en collision avec le fluorophore excité | Raccourcit la durée de vie | Augmente avec la température |
| Statique | Forme un complexe non fluorescent avant l'excitation | Aucun effet sur la durée de vie | Diminue avec la température |
Prêt à maîtriser l'extinction de la fluorescence dans votre laboratoire ? KINTEK est spécialisé dans les équipements et consommables de laboratoire de haute qualité, y compris les fluoromètres, les extincteurs et les réactifs essentiels pour des études de fluorescence précises. Que vous cherchiez à résoudre des problèmes d'extinction indésirable ou à développer des biocapteurs avancés, nos solutions garantissent des résultats précis et fiables. Contactez nos experts dès aujourd'hui pour optimiser vos expériences de fluorescence !
Guide Visuel
Produits associés
- Presse hydraulique chauffante avec plaques chauffantes manuelles intégrées pour utilisation en laboratoire
- Presse à chaud manuelle de laboratoire
- Presse hydraulique automatique chauffante 30T/40T à plaques chauffantes pour presse à chaud de laboratoire
- Presse hydraulique de laboratoire pour applications XRF KBR FTIR
- Machine de presse hydraulique chauffante 24T 30T 60T avec plaques chauffantes pour presse à chaud de laboratoire
Les gens demandent aussi
- Pourquoi la technologie de dépôt est-elle bonne ? Débloquez un contrôle au niveau atomique pour des matériaux supérieurs
- Quelle est la différence entre un four électrique et un four à arc électrique ? Un guide des méthodes de chauffage industriel
- Comment fonctionne le processus de centrifugation ? Débloquez une séparation rapide pour votre laboratoire
- Quelles précautions prendre lors d'une expérience de traitement thermique ? Protocoles de sécurité essentiels pour votre laboratoire
- Quelle est la fonction principale d'une pompe à vide ? Éliminer les molécules de gaz pour créer un vide contrôlé
- Comment les perles de fusion sont-elles préparées ? Maîtrisez la technique pour une analyse XRF impeccable
- Quelles caractéristiques faut-il prendre en compte lors du choix d'un congélateur à ultra-basse température ? Sécurisez vos échantillons avec précision
- Quel est l'appareil courant typique utilisé pour le chauffage ? Un guide des plaques chauffantes, des becs, des manteaux chauffants et des bains














