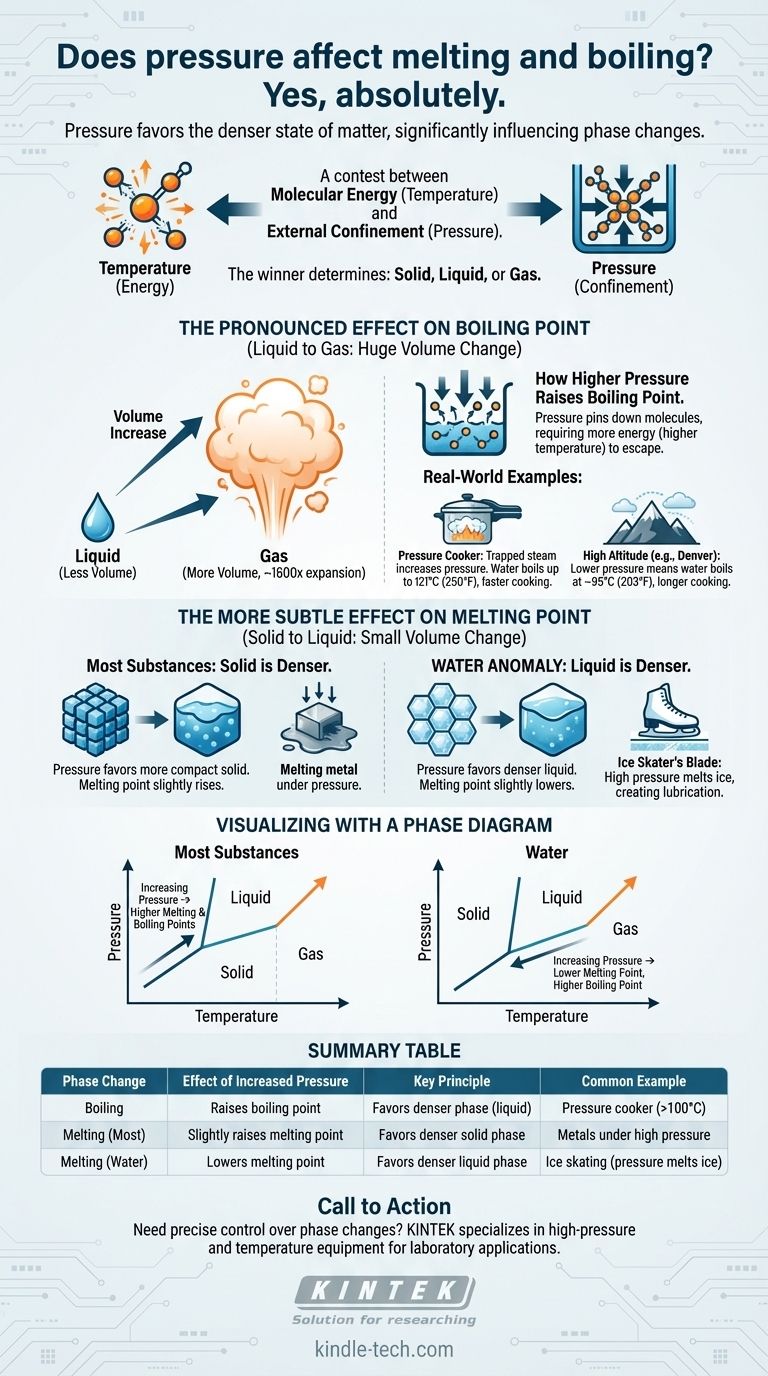
Oui, absolument. La pression est un facteur critique qui influence directement les températures auxquelles les substances changent de phase. L'augmentation de la pression externe élève généralement de manière significative le point d'ébullition d'un liquide. Son effet sur le point de fusion est plus subtil mais suit un principe clair : la pression favorise l'état de la matière le plus dense.
Le principe fondamental est une compétition entre l'énergie moléculaire (température) et le confinement externe (pression). La température donne aux molécules l'énergie nécessaire pour se libérer dans un état moins ordonné, tandis que la pression les force à se rapprocher dans un état plus compact et plus dense. Le vainqueur de cette compétition détermine si une substance est solide, liquide ou gazeuse.

Pourquoi la pression influence les changements de phase
La bataille entre l'énergie et le confinement
Un changement de phase, comme la fusion ou l'ébullition, se produit lorsque les molécules acquièrent suffisamment d'énergie thermique pour surmonter les forces qui les maintiennent dans une structure fixe. La température fournit cette énergie.
La pression, en revanche, est une force externe qui pousse les molécules les unes contre les autres. Elle agit comme une forme de confinement, rendant plus difficile pour les molécules de se disperser et de passer à une phase moins dense.
Une question de volume et de densité
La clé pour comprendre l'effet de la pression réside dans le volume. Lorsqu'une substance fond ou bout, son volume et sa densité changent.
La pression favorisera toujours la phase qui occupe le moins de volume, c'est-à-dire la phase la plus dense. Cette règle unique explique pourquoi la pression affecte différemment l'ébullition et la fusion.
L'effet prononcé sur le point d'ébullition
Du liquide au gaz : un énorme changement de volume
La transition d'un liquide à un gaz implique une augmentation massive du volume. Une seule goutte d'eau, par exemple, se dilate pour occuper un espace plus de 1 600 fois plus grand lorsqu'elle devient de la vapeur.
Parce que ce changement de volume est si important, la pression a un impact très fort et direct sur le point d'ébullition.
Comment une pression plus élevée augmente le point d'ébullition
Lorsque vous augmentez la pression sur la surface d'un liquide, vous "fixez" essentiellement les molécules. Elles nécessitent alors beaucoup plus d'énergie cinétique (une température plus élevée) pour s'échapper dans la phase gazeuse.
C'est pourquoi le point d'ébullition de presque toutes les substances augmente avec l'augmentation de la pression.
Exemple concret : l'autocuiseur
Un autocuiseur fonctionne en scellant une marmite, piégeant la vapeur produite par l'eau bouillante. Cette vapeur piégée augmente considérablement la pression à l'intérieur.
Sous cette haute pression, le point d'ébullition de l'eau peut passer de 100°C (212°F) à 121°C (250°F). Cette eau plus chaude transfère la chaleur plus rapidement, réduisant considérablement les temps de cuisson.
Exemple concret : cuisiner en haute altitude
L'inverse se produit en haute altitude. À Denver, Colorado (à 1 609 mètres), la pression atmosphérique est plus faible.
Avec moins de pression atmosphérique retenant les molécules d'eau, elles peuvent s'échapper plus facilement dans la phase gazeuse. L'eau y bout à environ 95°C (203°F), ce qui signifie que les aliments doivent être cuits plus longtemps.
L'effet plus subtil sur le point de fusion
Du solide au liquide : un petit changement de volume
Contrairement à l'ébullition, le changement de volume pendant la fusion est très faible. Les densités d'une substance sous ses formes solide et liquide sont généralement assez similaires.
Parce que le changement de volume est minimal, la pression a un effet beaucoup moins spectaculaire sur le point de fusion.
Pour la plupart des substances : une pression plus élevée augmente le point de fusion
La plupart des matériaux, des métaux aux cires en passant par le dioxyde de carbone, sont plus denses sous leur forme solide que sous leur forme liquide.
Dans ces cas, l'augmentation de la pression favorise la phase solide plus compacte. Cela rend la fusion légèrement plus difficile, de sorte qu'une température plus élevée est nécessaire. Le point de fusion augmente avec la pression.
L'anomalie de l'eau : une exception cruciale
L'eau est une exception remarquable et rare. L'eau solide (la glace) est moins dense que l'eau liquide, c'est pourquoi la glace flotte.
Parce que l'eau liquide est la phase la plus dense, l'augmentation de la pression sur la glace favorise la formation de liquide. Cela signifie que sous haute pression, la glace fondra à une température inférieure à 0°C (32°F).
Exemple concret : la lame du patineur sur glace
L'illustration classique de ce principe est un patineur sur glace. La fine lame du patin concentre tout le poids du patineur sur une minuscule surface, créant une pression immense sur la glace.
Cette haute pression fait fondre la glace directement sous la lame à une température légèrement inférieure, créant une couche microscopique d'eau qui lubrifie le chemin de la lame.
Comprendre les compromis : visualisation avec un diagramme de phase
Un diagramme de phase est une carte simple qui montre l'état d'une substance (solide, liquide ou gaz) pour toute combinaison de température et de pression.
La limite liquide-gaz
La ligne séparant les phases liquide et gazeuse monte toujours vers la droite. Cela confirme visuellement qu'à mesure que vous augmentez la pression (en montant sur l'axe vertical), vous devez également augmenter la température (en allant vers la droite sur l'axe horizontal) pour faire bouillir la substance.
La limite solide-liquide
La ligne entre les phases solide et liquide est presque verticale, montrant que la pression a une influence beaucoup plus faible sur la fusion.
Pour la plupart des substances, cette ligne penche légèrement vers la droite (pression plus élevée, point de fusion plus élevé). Pour l'eau, cette ligne penche uniquement vers la gauche, montrant qu'une pression plus élevée entraîne un point de fusion plus bas.
Principes clés pour l'application pratique
Pour appliquer efficacement ces connaissances, concentrez-vous sur la substance et le type de changement de phase impliqué.
- Si vous traitez de l'ébullition ou de la condensation : N'oubliez pas que la pression est le facteur dominant. Une pression plus élevée signifie un point d'ébullition plus élevé, et une pression plus basse signifie un point d'ébullition plus bas.
- Si vous traitez de la fusion ou de la congélation (pour la plupart des matériaux) : L'effet de la pression est mineur. Une pression plus élevée augmentera légèrement le point de fusion en favorisant l'état solide plus dense.
- Si vous traitez spécifiquement de la glace d'eau : N'oubliez pas que c'est l'exception. Une pression plus élevée abaisse le point de congélation/fusion en favorisant l'état liquide plus dense.
Comprendre comment la pression et la température interagissent vous donne un contrôle direct sur l'état physique de la matière.
Tableau récapitulatif :
| Changement de phase | Effet d'une pression accrue | Principe clé | Exemple courant |
|---|---|---|---|
| Ébullition | Augmente le point d'ébullition | Favorise la phase plus dense (liquide) | Autocuiseur (l'eau bout à >100°C) |
| Fusion (la plupart des matériaux) | Augmente légèrement le point de fusion | Favorise la phase solide plus dense | Métaux sous haute pression |
| Fusion (eau/glace) | Abaisse le point de fusion | Favorise la phase liquide plus dense | Patinage sur glace (la pression fait fondre la glace) |
Besoin d'un contrôle précis des changements de phase dans vos processus de laboratoire ? KINTEK est spécialisé dans les équipements haute pression et haute température pour les applications de laboratoire. Que vous développiez de nouveaux matériaux, meniez des synthèses chimiques ou étudiiez le comportement de phase, nos réacteurs et fours offrent le contrôle exact de la pression et de la température dont vous avez besoin. Contactez nos experts dès aujourd'hui pour discuter de la manière dont nos solutions peuvent améliorer l'efficacité et la précision de votre recherche.
Guide Visuel
Produits associés
- Réacteurs haute pression personnalisables pour des applications scientifiques et industrielles avancées
- Mini réacteur autoclave haute pression SS pour utilisation en laboratoire
- Réacteur Autoclave de Laboratoire Haute Pression pour Synthèse Hydrothermale
- Réacteur Autoclave Haute Pression en Acier Inoxydable pour Laboratoire
- Four à tube sous vide haute pression de laboratoire
Les gens demandent aussi
- Quels sont les inconvénients des pompes à vide à palettes rotatives ? Comprendre les compromis liés à l'huile
- Quelle est la tension du pulvérisation cathodique CC ? Haute tension pour un dépôt métallique efficace
- Pourquoi la pyrolyse est-elle importante dans la gestion des déchets ? Transformer les déchets en carburant, en sol et en nouveaux matériaux
- Quelles sont les différentes méthodes de contrôle de la température dans un four à résistance ? Maîtriser la gestion thermique de précision
- Comment les incubateurs maintiennent-ils une température constante ? Contrôle de précision pour une culture cellulaire fiable
- Quelles sont les alternatives aux diamants cultivés en laboratoire ? Comparez les diamants naturels, la moissanite et plus encore
- Pourquoi des homogénéisateurs à haute énergie sont-ils nécessaires pour les biopolymères microbiens haute performance ? Obtenir une dispersion supérieure
- Quelle est la température pour la pyrolyse lente ? Maximiser le rendement en biochar à 400°C



















