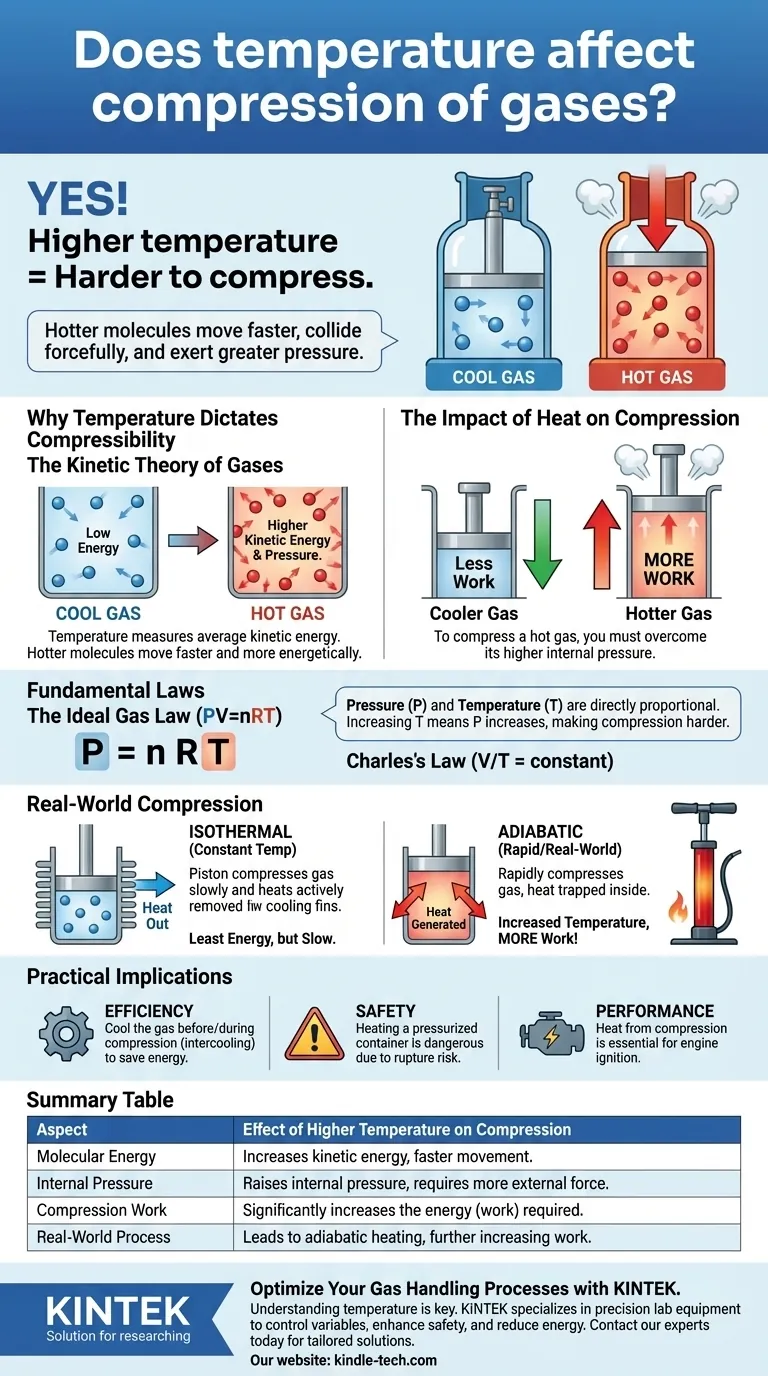
Oui, la température a un effet direct et critique sur la compression des gaz. Un gaz à une température plus élevée est beaucoup plus difficile à comprimer que le même gaz à une température plus basse. Cela s'explique par le fait que la température est une mesure de l'énergie cinétique des molécules de gaz ; les molécules plus chaudes se déplacent plus rapidement, entrent en collision plus violemment avec les parois de leur contenant et exercent donc une pression plus importante qui doit être surmontée.
Le principe fondamental est que comprimer un gaz nécessite un travail pour vaincre la pression exercée par ses molécules. Étant donné qu'un gaz plus chaud exerce plus de pression à un volume donné, il nécessite plus de travail pour être comprimé.

Pourquoi la température dicte la compressibilité
Pour comprendre la relation entre la température et la compression, nous devons examiner le comportement des molécules de gaz. Ceci est expliqué par la théorie cinétique des gaz.
La théorie cinétique des gaz
La température est une mesure macroscopique de l'énergie cinétique moyenne des molécules d'une substance. Des températures plus élevées signifient que les molécules de gaz individuelles se déplacent plus rapidement et avec plus d'énergie.
Un gaz froid a des molécules avec une énergie cinétique moyenne plus faible, ce qui signifie qu'elles se déplacent plus lentement. Un gaz chaud a des molécules avec une énergie cinétique moyenne plus élevée, ce qui les fait se déplacer beaucoup plus rapidement.
La pression comme résultat des collisions moléculaires
La pression qu'un gaz exerce est le résultat d'innombrables molécules entrant en collision avec les parois de leur contenant. Chaque collision transmet une petite quantité de force.
Lorsque les molécules sont plus chaudes et se déplacent plus rapidement, elles frappent les parois du contenant plus fréquemment et avec plus de force, ce qui entraîne une pression plus élevée.
L'impact de la chaleur sur la compression
Comprimer un gaz signifie forcer ses molécules dans un volume plus petit. Pour ce faire, vous devez appliquer une pression externe supérieure à la pression interne du gaz.
Parce qu'un gaz chaud exerce naturellement une pression interne plus élevée, vous devez appliquer une force externe considérablement plus grande pour le comprimer au même volume qu'un gaz plus froid.
Les lois fondamentales en jeu
Cette relation n'est pas seulement théorique ; elle est précisément décrite par des lois fondamentales des gaz qui forment la base de la thermodynamique.
La loi des gaz parfaits (PV=nRT)
La loi des gaz parfaits est l'équation unificatrice : Pression (P) × Volume (V) = moles de gaz (n) × constante des gaz (R) × Température (T).
Cette équation montre que la pression et la température sont directement proportionnelles. Si vous maintenez le volume constant et augmentez la température (T), la pression (P) doit également augmenter. Cela confirme pourquoi un gaz plus chaud est plus difficile à comprimer—il commence à une pression plus élevée ou y monte.
La loi de Charles (V/T = constante)
La loi de Charles stipule que pour une quantité fixe de gaz à pression constante, le volume est directement proportionnel à sa température absolue.
Bien que cela décrive l'expansion lors du chauffage, son inverse est tout aussi vrai pour la compression. Pour maintenir une pression constante tout en réduisant le volume, vous devriez réduire proportionnellement la température.
Réalités pratiques et compromis clés
Dans les applications du monde réel, le processus de compression lui-même introduit une complication critique : la chaleur.
Le cas idéalisé : compression isotherme
La compression isotherme suppose que la température du gaz est maintenue parfaitement constante tout au long du processus.
Pour y parvenir, vous auriez besoin d'éliminer activement et continuellement la chaleur générée par l'acte de compression. Ce processus nécessite le moins d'énergie (travail) mais est souvent lent et peu pratique.
Le cas du monde réel : compression adiabatique
Dans presque tous les scénarios de compression rapide, comme dans un cylindre de moteur ou une pompe à vélo, le processus est plus proche de l'adiabatique. Cela signifie qu'aucune chaleur n'est autorisée à s'échapper du système.
Toute l'énergie que vous mettez dans la compression du gaz augmente son énergie interne, provoquant une augmentation rapide et significative de la température. C'est pourquoi une pompe à vélo chauffe pendant son utilisation.
La conséquence : travail accru requis
Ce chauffage adiabatique joue contre vous. Au fur et à mesure que vous comprimez le gaz, sa température augmente, ce qui augmente encore davantage sa pression interne.
Vous luttez maintenant contre une force d'opposition continuellement croissante. C'est pourquoi la compression dans le monde réel nécessite toujours plus de travail que l'idéal théorique à température constante. Les compresseurs multi-étages avec refroidisseurs intermédiaires sont utilisés dans l'industrie spécifiquement pour lutter contre cet effet.
Faire le bon choix pour votre objectif
Comprendre cette relation est crucial pour l'efficacité, la sécurité et la performance dans tout système impliquant des gaz comprimés.
- Si votre objectif principal est l'efficacité industrielle : Refroidir le gaz avant et pendant la compression (un processus connu sous le nom de refroidissement intermédiaire) réduira considérablement l'énergie nécessaire pour le comprimer.
- Si votre objectif principal est la sécurité : Reconnaissez que chauffer un récipient scellé et pressurisé est extrêmement dangereux car la pression interne augmentera proportionnellement à la température, créant un risque de rupture.
- Si votre objectif principal est la performance du moteur : La chaleur générée pendant la course de compression d'un moteur à combustion interne est essentielle pour enflammer le mélange air-carburant, convertissant cette énergie thermique en travail mécanique.
En fin de compte, la température n'est pas une variable passive mais un participant actif dans le travail de compression d'un gaz.
Tableau récapitulatif :
| Aspect | Effet d'une température plus élevée sur la compression |
|---|---|
| Énergie moléculaire | Augmente l'énergie cinétique, faisant bouger les molécules plus vite. |
| Pression interne | Augmente la pression interne du gaz, nécessitant une force externe plus importante pour comprimer. |
| Travail de compression | Augmente considérablement l'énergie (travail) nécessaire à la compression. |
| Processus réel | Entraîne un échauffement adiabatique, augmentant davantage la résistance et le travail nécessaire. |
Optimisez vos processus de manipulation des gaz avec KINTEK
Comprendre la relation critique entre la température et la compression des gaz est essentiel pour l'efficacité, la sécurité et la performance dans tout environnement de laboratoire ou industriel. Que vous conceviez un nouveau système ou optimisiez un système existant, la gestion des effets thermiques est primordiale.
KINTEK se spécialise dans les équipements de laboratoire de précision et les consommables qui vous aident à contrôler ces variables. Des environnements à température contrôlée aux systèmes de compression efficaces, nos solutions sont conçues pour améliorer la sécurité de votre flux de travail et réduire la consommation d'énergie.
Laissez-nous vous aider à obtenir d'excellents résultats. Contactez nos experts dès aujourd'hui via notre formulaire de contact pour discuter de la manière dont nos solutions sur mesure peuvent répondre à vos besoins et défis spécifiques en laboratoire.
Guide Visuel
Produits associés
- Fabricant de pièces personnalisées en PTFE Téflon pour applications de vannes pneumatiques
- Moule de Presse à Billes pour Laboratoire
- Presse hydraulique manuelle chauffante avec plaques chauffantes pour presse à chaud de laboratoire
- Presse à moule polygonale pour laboratoire
- Presse Thermique Automatique de Laboratoire
Les gens demandent aussi
- Qu'est-ce qui détermine la teneur en cendres ? Comprenez les facteurs clés qui influencent la teneur en minéraux de votre matériau.
- Quelle est la valeur de l'huile de pyrolyse ? Un guide pour évaluer ce biocarburant complexe
- Pourquoi le graphite ne peut-il pas conduire l'électricité ? Le secret de sa haute conductivité électrique dévoilé
- Quel est le processus de traitement thermique des métaux non ferreux ? Maîtriser le recuit et le durcissement par précipitation
- Comment choisir un filtre-presse ? Adaptez la bonne technologie à votre boue pour des résultats optimaux
- Quel rôle joue une étuve de laboratoire dans la préparation des membranes zéolithiques ? Assurer l'intégrité structurelle et le succès
- Quel est l'objectif d'un rotavap ? Obtenez une élimination douce et efficace des solvants pour votre laboratoire
- Qu'est-ce que le processus de pulvérisation cathodique de films minces ? Un guide pour un dépôt PVD de haute qualité



















