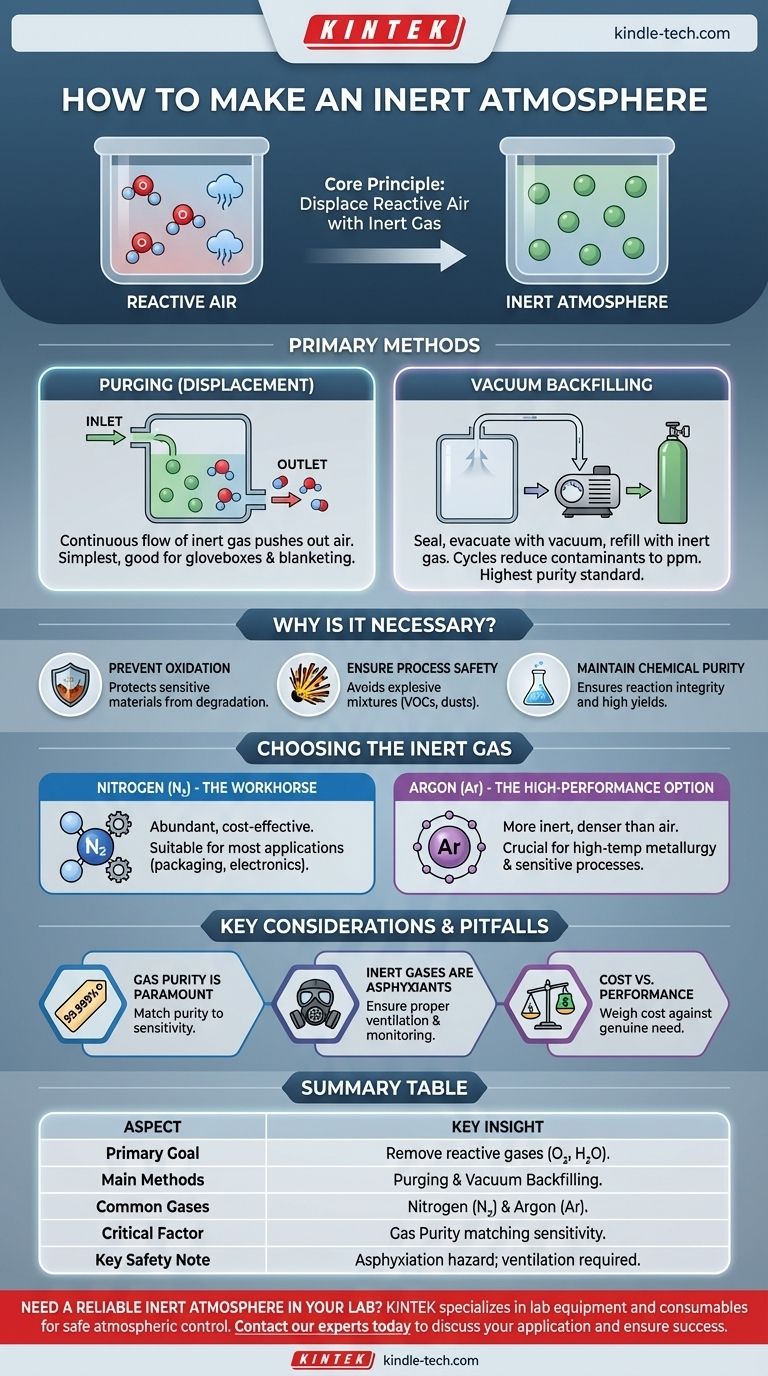
En pratique, une atmosphère inerte est créée en déplaçant physiquement l'air réactif à l'intérieur d'un espace confiné et en le remplaçant par un gaz non réactif. Les deux méthodes principales pour y parvenir sont le purgeage, qui implique de faire circuler un gaz inerte pour chasser l'air, et le remplissage sous vide, où l'air est d'abord retiré à l'aide d'une pompe à vide, puis l'espace est rempli de gaz inerte.
L'objectif fondamental de la création d'une atmosphère inerte n'est pas seulement d'ajouter un gaz spécial, mais d'éliminer activement les gaz réactifs — principalement l'oxygène et la vapeur d'eau. Cela protège les matériaux et les procédés sensibles contre les réactions chimiques indésirables, la dégradation et les risques pour la sécurité.

Le principe fondamental : Pourquoi l'inertage est nécessaire
La création d'une atmosphère inerte, ou « inertage », est une technique fondamentale en science et dans l'industrie. Elle est utilisée chaque fois que l'air ambiant interférerait avec le résultat souhaité.
Pour prévenir l'oxydation et la dégradation
De nombreux matériaux, des produits chimiques fins et des produits pharmaceutiques aux métaux à haute température, réagissent avec l'oxygène. Ce processus, appelé oxydation, peut dégrader la qualité du produit, modifier les propriétés chimiques ou créer des impuretés. Une atmosphère inerte élimine l'oxygène, interrompant ainsi efficacement ces voies de dégradation.
Pour assurer la sécurité des procédés
Les composés organiques volatils (COV) ou les poussières combustibles fines peuvent former un mélange explosif avec l'oxygène de l'air. En remplaçant l'oxygène par un gaz inerte, vous pouvez abaisser la concentration d'oxygène en dessous de la limite inférieure d'explosivité (LIE), prévenant ainsi les incendies et les explosions dans les réacteurs, les réservoirs de stockage et les conduites de transfert.
Pour maintenir la pureté chimique
Dans la synthèse chimique sensible, comme en chimie organométallique, les réactifs peuvent être détruits par des traces d'oxygène ou d'eau. Une atmosphère inerte n'est pas seulement une suggestion, mais une exigence pour garantir que la réaction se déroule comme prévu et permette d'obtenir un rendement élevé du produit désiré.
Méthodes clés pour créer une atmosphère inerte
La méthode que vous choisissez dépend de la géométrie de votre contenant et du niveau de pureté requis.
Méthode 1 : Le purgeage (Déplacement)
Le purgeage est la méthode la plus simple. Elle consiste à introduire un flux continu de gaz inerte dans une enceinte, généralement par une entrée à une extrémité, tout en permettant à l'air déplacé de s'échapper par une sortie à l'autre.
Cela fonctionne comme essayer de vider l'air enfumé d'une bouteille en y soufflant de l'air pur. Finalement, la fumée est diluée et expulsée. Cette méthode est courante pour les boîtes à gants, les lignes Schlenk et le recouvrement de l'espace libre des réservoirs de stockage.
Méthode 2 : Le remplissage sous vide
Pour le plus haut niveau de pureté, le remplissage sous vide est supérieur. Le processus consiste à sceller la chambre, à utiliser une pompe à vide pour évacuer presque tout l'air, puis à remplir la chambre avec un gaz inerte de haute pureté.
Ce cycle d'évacuation et de remplissage peut être répété plusieurs fois (généralement 3 à 5 cycles) pour réduire les contaminants atmosphériques traces à des niveaux de parties par million (ppm) ou moins. C'est la méthode standard pour les applications très sensibles.
Choisir le bon gaz inerte
Bien que plusieurs gaz soient non réactifs, deux dominent presque toutes les applications en raison de leur disponibilité et de leurs propriétés.
Azote (N₂) : Le cheval de bataille
Le gaz azote est le choix le plus courant. Il est séparé industriellement de l'air, ce qui le rend abondant et économique. Il convient à la grande majorité des applications, y compris l'emballage alimentaire, la fabrication d'appareils électroniques et le recouvrement chimique général.
Argon (Ar) : L'option haute performance
L'argon est plus inerte que l'azote et est crucial pour les procédés où l'azote pourrait encore réagir, comme en métallurgie à haute température où des nitrures métalliques pourraient se former. L'argon est également plus dense que l'air, ce qui lui permet de former un « couverture » stable au-dessus des matériaux sensibles dans un contenant ouvert, déplaçant l'air plus léger vers le haut.
Comprendre les compromis et les pièges
La mise en œuvre réussie d'une atmosphère inerte nécessite une attention aux détails au-delà du simple choix d'un gaz.
La pureté du gaz est primordiale
Le terme « gaz inerte » n'est que la moitié de l'histoire. La pureté du gaz est ce qui compte vraiment. Utiliser une bouteille d'azote de « qualité industrielle » contenant 100 ppm d'oxygène ne protégera pas une réaction sensible à 5 ppm d'oxygène. Faites toujours correspondre la pureté du gaz (par exemple, 99,999 % ou « cinq neufs ») à la sensibilité de votre application.
Les gaz inertes sont des asphyxiants
Une considération de sécurité essentielle est que les gaz inertes déplacent l'oxygène. Toute fuite dans un endroit mal ventilé peut créer une atmosphère déficiente en oxygène, présentant un grave risque d'asphyxie. Assurez-vous toujours d'une ventilation adéquate et utilisez des moniteurs d'oxygène si nécessaire.
Coût par rapport à la performance
Il existe un compromis direct en matière de coûts. L'azote est nettement moins cher que l'argon. Vous devez évaluer le coût supplémentaire de l'argon par rapport au besoin réel de son niveau d'inertie plus élevé. Pour la plupart des applications, l'azote est le choix le plus pratique et le plus économique.
Sélectionner la bonne approche pour votre application
Votre décision finale doit être guidée par vos exigences techniques et de sécurité spécifiques.
- Si votre objectif principal est le stockage à usage général ou la prévention de l'oxydation de base : Le purgeage avec un flux continu et faible d'azote de pureté standard est efficace et économique.
- Si votre objectif principal est la métallurgie à haute température ou la chimie très sensible : Le remplissage sous vide avec de l'argon de haute pureté est la norme requise pour prévenir les réactions secondaires indésirables.
- Si votre objectif principal est la prévention des incendies et des explosions dans un grand récipient : Le recouvrement de l'espace libre avec de l'azote pour maintenir le niveau d'oxygène en dessous de la limite d'explosivité est la mesure de sécurité critique.
- Si votre objectif principal est la chimie sensible à l'air à l'échelle du laboratoire : Le purgeage d'une ligne Schlenk ou d'une boîte à gants avec de l'azote ou de l'argon est la configuration de laboratoire standard.
Maîtriser le contrôle atmosphérique est la clé pour assurer la sécurité, la pureté et la fiabilité de vos procédés sensibles.
Tableau récapitulatif :
| Aspect | Idée clé |
|---|---|
| Objectif principal | Éliminer les gaz réactifs (oxygène, vapeur d'eau) pour protéger les matériaux et les procédés. |
| Méthodes principales | Purgeage (pour la simplicité) et Remplissage sous vide (pour la haute pureté). |
| Gaz courants | Azote (économique) et Argon (haute performance). |
| Facteur critique | La pureté du gaz doit correspondre à la sensibilité de l'application. |
| Note de sécurité clé | Les gaz inertes sont des asphyxiants ; assurez une ventilation et une surveillance adéquates. |
Besoin de mettre en place une atmosphère inerte fiable dans votre laboratoire ?
KINTEK est spécialisé dans l'équipement et les consommables de laboratoire, fournissant les outils précis et les conseils d'experts dont vous avez besoin pour un contrôle atmosphérique sûr et efficace. Que vous travailliez avec une synthèse chimique sensible, des procédés à haute température ou que vous ayez besoin de prévention des explosions, nous pouvons vous aider à choisir la bonne solution — des systèmes de purification de gaz aux pompes à vide et aux chambres spécialisées.
Contactez nos experts dès aujourd'hui pour discuter de votre application spécifique et garantir la pureté, la sécurité et le succès de votre travail.
Guide Visuel
Produits associés
- Four à atmosphère contrôlée 1200℃ Four à atmosphère inerte d'azote
- Four à atmosphère contrôlée 1700℃ Four à atmosphère inerte d'azote
- Four à atmosphère contrôlée de 1400℃ avec atmosphère d'azote et inerte
- Four à atmosphère d'hydrogène contrôlée à l'azote
- Four à tube de laboratoire à haute température de 1400℃ avec tube en alumine
Les gens demandent aussi
- Quel est l'objectif d'une atmosphère inerte ? Un guide pour protéger vos matériaux et vos processus
- Qu'est-ce qu'une atmosphère inerte ? Un guide pour prévenir l'oxydation et assurer la sécurité
- Qu'est-ce qui fournit une atmosphère inerte ? Atteignez la sécurité et la pureté avec l'azote, l'argon ou le CO2
- Pourquoi l'azote est-il utilisé dans un four ? Un bouclier rentable pour les processus à haute température
- Qu'est-ce qu'une atmosphère inerte ? Un guide pour prévenir les incendies et les explosions



















