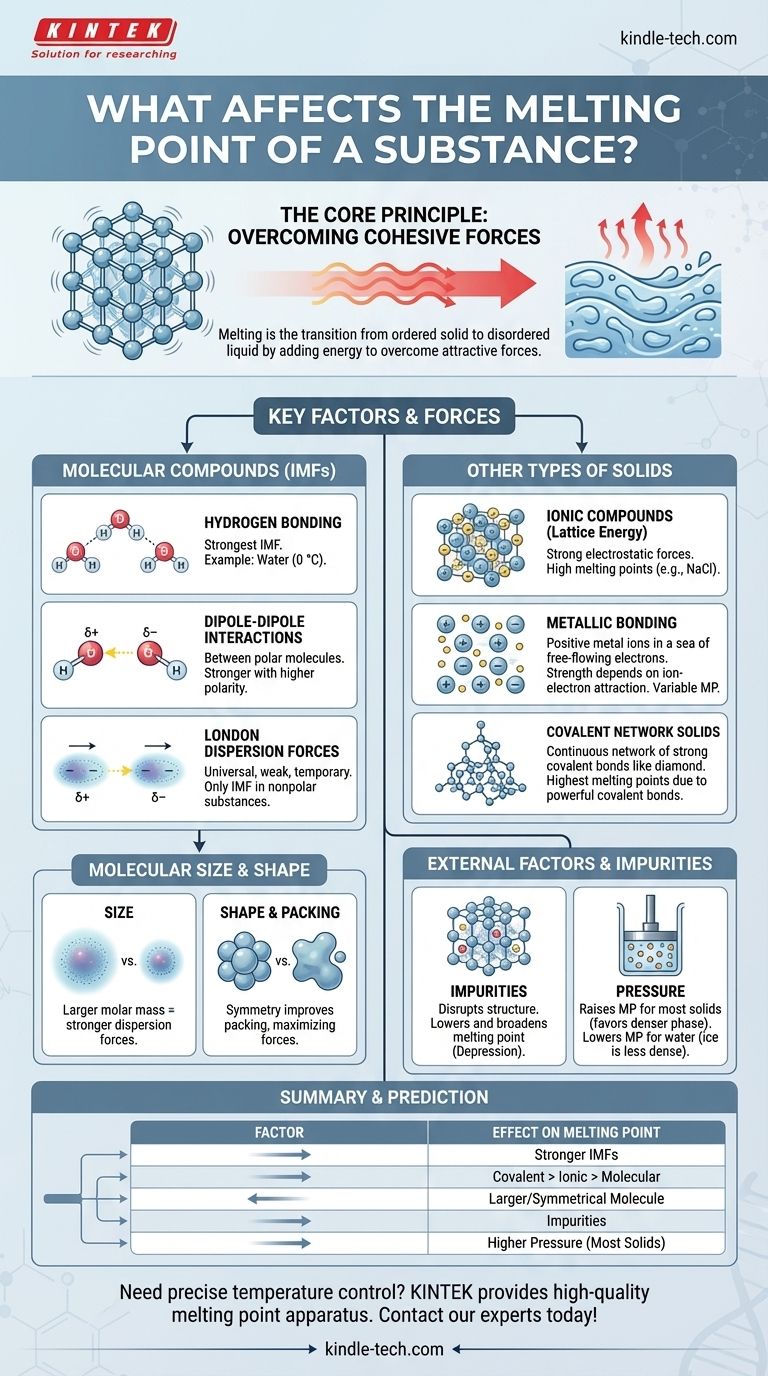
À la base, le point de fusion d'une substance est déterminé par l'énergie nécessaire pour surmonter les forces d'attraction qui maintiennent ses particules dans une structure fixe et tridimensionnelle. Les principaux facteurs sont la force de ces forces – qu'il s'agisse de liaisons chimiques ou de forces intermoléculaires plus faibles – et la manière dont les particules s'assemblent. Des facteurs tels que la taille moléculaire, la forme et la présence d'impuretés jouent également un rôle crucial.
Le principe central est simple : des forces d'attraction plus fortes entre les particules nécessitent plus d'énergie thermique pour être rompues, ce qui entraîne un point de fusion plus élevé. Toute l'histoire des points de fusion est une exploration de ce qui crée et modifie ces forces.

Le principe fondamental : surmonter les forces de cohésion
La fusion est une transformation physique d'un état solide ordonné à un état liquide désordonné. Comprendre cette transition est essentiel pour comprendre les facteurs qui la contrôlent.
Qu'est-ce que la fusion ?
Dans un solide, les atomes, les ions ou les molécules sont enfermés dans un arrangement fixe appelé réseau cristallin. Ils vibrent sur place mais ne se déplacent pas les uns par rapport aux autres.
La fusion se produit à la température spécifique où ces particules acquièrent suffisamment d'énergie cinétique de la chaleur pour se libérer de leurs positions fixes et commencer à s'écouler.
Énergie vs. Cohésion
La chaleur que vous ajoutez à une substance augmente l'énergie cinétique de ses particules, les faisant vibrer plus intensément. Le point de fusion est la température d'équilibre où cette énergie vibratoire devient suffisamment puissante pour surmonter les forces de cohésion qui maintiennent le réseau ensemble.
Facteurs clés pour les composés moléculaires
Pour les substances composées de molécules discrètes (comme l'eau, la cire ou le sucre), ce sont les forces entre les molécules – et non les liaisons à l'intérieur de celles-ci – qui se rompent pendant la fusion. Celles-ci sont appelées forces intermoléculaires (FIM).
Liaison hydrogène : la FIM la plus forte
Une liaison hydrogène est un type puissant d'interaction dipôle-dipôle qui se produit lorsque l'hydrogène est lié à un atome très électronégatif comme l'azote (N), l'oxygène (O) ou le fluor (F).
L'eau (H₂O) en est un exemple classique. Son point de fusion élevé (0 °C) par rapport à des molécules de taille similaire est entièrement dû au réseau solide de liaisons hydrogène qui maintiennent les molécules ensemble dans la glace.
Interactions dipôle-dipôle
Ces forces existent entre les molécules polaires, qui ont des extrémités partielles positives et partielles négatives permanentes. L'extrémité positive d'une molécule attire l'extrémité négative de sa voisine.
Plus la polarité de la molécule est grande, plus l'attraction dipôle-dipôle est forte, et plus le point de fusion est élevé.
Forces de dispersion de London : la force universelle
Ces attractions temporaires et faibles existent dans toutes les molécules, polaires et non polaires. Elles proviennent de fluctuations momentanées dans le nuage électronique autour d'une molécule, créant des dipôles éphémères.
Pour les substances non polaires comme le méthane (CH₄) ou l'octane (C₈H₁₈), les forces de dispersion de London sont les seules FIM présentes.
Le rôle de la taille et de la forme moléculaires
Taille (Masse molaire) : Les molécules plus grandes ont des nuages électroniques plus grands, qui sont plus facilement déformés. Cela conduit à des forces de dispersion de London plus fortes et, par conséquent, à des points de fusion plus élevés. C'est pourquoi les grands hydrocarbures cireux sont solides à température ambiante tandis que les petits comme le méthane sont des gaz.
Symétrie et Empilement : Les molécules symétriques et compactes peuvent s'emballer plus étroitement et efficacement dans un réseau cristallin. Cet empilement serré maximise l'efficacité des forces intermoléculaires, conduisant à un point de fusion plus élevé que pour les isomères de forme irrégulière de même taille.
Au-delà des molécules : autres types de solides
Tous les solides ne sont pas constitués de molécules discrètes. Dans de nombreux matériaux, la fusion nécessite la rupture de liaisons chimiques puissantes qui s'étendent à travers toute la structure.
Composés ioniques et énergie réticulaire
Dans les composés ioniques comme le sel de table (NaCl), les ions positifs et négatifs sont maintenus dans un réseau rigide par de fortes forces électrostatiques (liaisons ioniques). La fusion de ces substances nécessite de surmonter cette immense attraction, qui est mesurée par l'énergie réticulaire.
Parce que les liaisons ioniques sont beaucoup plus fortes que les forces intermoléculaires, les composés ioniques ont des points de fusion très élevés.
Métaux et liaison métallique
Les métaux sont maintenus ensemble par des liaisons métalliques, où une "mer" d'électrons délocalisés circule librement parmi un réseau fixe d'ions métalliques positifs.
La force d'attraction entre les ions et cette mer d'électrons détermine le point de fusion. Des métaux comme le tungstène et le titane forment des liaisons métalliques très fortes et ont des points de fusion exceptionnellement élevés.
Solides à réseau covalent
Dans ces matériaux, les atomes sont unis par un réseau continu de fortes liaisons covalentes. Il n'y a pas de molécules individuelles.
Pour faire fondre un solide à réseau covalent comme le diamant (carbone) ou le quartz (dioxyde de silicium), il faut rompre ces puissantes liaisons covalentes. Cela nécessite une quantité énorme d'énergie, ce qui leur confère les points de fusion les plus élevés de toutes les classes de substances.
Comprendre les compromis et les facteurs externes
Les propriétés intrinsèques d'une substance ne sont pas la seule influence. Les conditions externes et la composition ont également un impact significatif.
L'effet des impuretés : abaissement du point de fusion
La présence d'une impureté perturbe la structure uniforme d'un réseau cristallin. Ce réseau affaibli et désorganisé nécessite moins d'énergie pour se désagréger.
Ce phénomène est connu sous le nom d'abaissement du point de fusion. C'est pourquoi une substance pure a un point de fusion net et distinct, tandis qu'une substance impure fond sur une plage de température plus large et plus basse. C'est aussi le principe derrière l'utilisation du sel pour faire fondre la glace sur les routes en hiver.
L'influence de la pression
Pour la plupart des substances, la phase solide est plus dense que la phase liquide. L'augmentation de la pression favorise l'état plus dense, rapprochant les particules et rendant plus difficile pour elles de se libérer. Par conséquent, pour la plupart des matériaux, une pression plus élevée augmente le point de fusion.
L'eau est une exception célèbre. Parce que la glace est moins dense que l'eau liquide, l'augmentation de la pression favorise l'état liquide, abaissant ainsi le point de fusion.
Comment prédire les points de fusion relatifs
Utilisez ces principes pour comparer différentes substances et prédire leur comportement.
- Si vous comparez un réseau covalent, un composé ionique et un composé moléculaire : Le réseau covalent (par exemple, le diamant) sera le plus élevé, suivi du composé ionique (par exemple, le sel), le composé moléculaire (par exemple, le sucre) étant beaucoup plus bas.
- Si vous comparez des composés moléculaires : Tout d'abord, vérifiez la présence de liaisons hydrogène, qui est un facteur dominant. Si elles sont absentes, comparez la polarité. Si elles sont toutes non polaires ou ont une polarité similaire, celle qui a la masse molaire la plus élevée aura généralement le point de fusion le plus élevé.
- Si vous comparez des composés ioniques : Le composé avec les charges les plus élevées sur ses ions et/ou les rayons ioniques les plus petits aura une énergie réticulaire plus forte et un point de fusion plus élevé.
- Si vous devez évaluer la pureté : Une substance qui fond nettement à son point de fusion connu est probablement pure, tandis qu'une substance qui fond progressivement sur une plage inférieure à son point attendu est impure.
En comprenant ces forces fondamentales, vous pouvez prédire efficacement comment la structure microscopique d'une substance dicte son comportement de fusion.
Tableau récapitulatif :
| Facteur | Effet sur le point de fusion | Principe clé |
|---|---|---|
| Forces intermoléculaires (FIM) | Plus élevé avec des FIM plus fortes | Liaison hydrogène > dipôle-dipôle > dispersion de London |
| Type de liaison chimique | Réseau covalent > Ionique > Métallique > Moléculaire | Force des liaisons qui doivent être rompues |
| Taille/Forme moléculaire | Plus élevé avec une masse molaire plus grande et une forme symétrique | Augmente les forces de London et améliore l'empilement du réseau |
| Impuretés | Abaisse (Abaissement du point de fusion) | Perturbe le réseau cristallin, nécessitant moins d'énergie pour fondre |
| Pression | Augmente (pour la plupart des solides) ; Abaisse (pour la glace/l'eau) | Favorise la phase plus dense (solide pour la plupart, liquide pour l'eau) |
Besoin d'un contrôle précis de la température pour l'analyse de vos matériaux ? La compréhension des points de fusion est essentielle pour la caractérisation des matériaux, l'évaluation de la pureté et le développement de processus. KINTEK est spécialisé dans la fourniture d'équipements de laboratoire de haute qualité, y compris des appareils de point de fusion et des fours, pour aider votre laboratoire à obtenir des résultats précis et fiables. Contactez nos experts dès aujourd'hui pour trouver la solution parfaite pour votre application spécifique !
Guide Visuel
Produits associés
- Four à moufle de laboratoire à moufle à levage par le bas
- Four à moufle de 1800℃ pour laboratoire
- Four à moufle de four à étuve de 1400℃ pour laboratoire
- Four à moufle de 1700℃ pour laboratoire
- Four à tube de laboratoire à haute température de 1400℃ avec tube en alumine
Les gens demandent aussi
- Quelles sont les trois solutions potentielles au problème des déchets plastiques ? Un guide sur le recyclage, les bioplastiques et l'upcycling
- Quel appareil est utilisé pour le chauffage en laboratoire ? Un guide pour choisir l'outil adapté
- Quel est un exemple de pyrolyse rapide ? Conversion de la biomasse en bio-huile en moins de 2 secondes
- Comment la pression du gaz de pulvérisation affecte-t-elle la qualité et le taux de dépôt du film ? Maîtriser le compromis pour des résultats optimaux
- Quel rôle joue un four de séchage dans la préparation du molybdate de sodium ? Assurer des cristaux purs grâce à un contrôle thermique précis
- Quelles sont les propriétés physiques de l'azote gazeux ? Un guide sur sa puissance et ses dangers invisibles
- Quels matériaux vitreux sont utilisés dans le frittage ? Matériaux clés et applications pour la fabrication de précision
- Que fait l'équipement de brasage ? Créer des joints métalliques solides et permanents avec précision



















