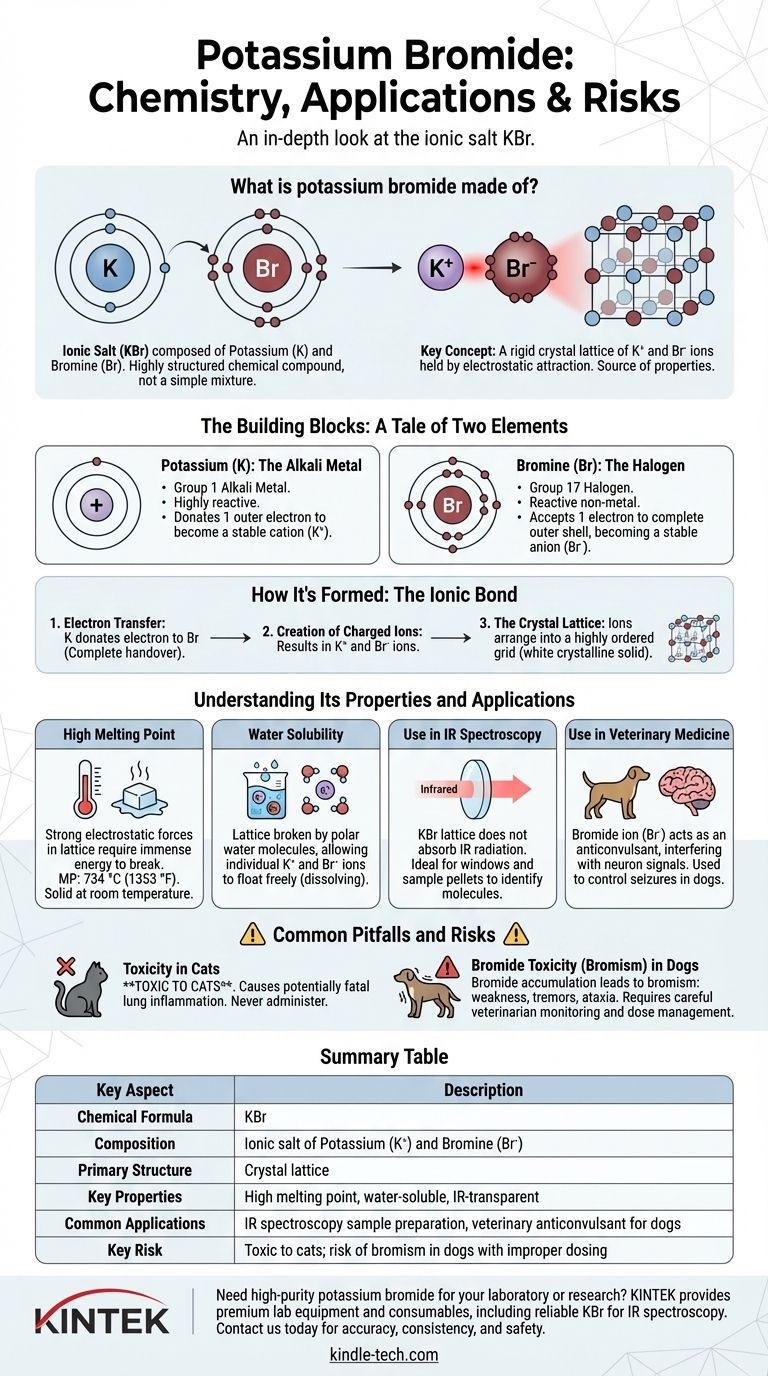
En bref, le bromure de potassium est un sel ionique composé des éléments potassium et brome. Ce n'est pas un simple mélange, mais un composé chimique hautement structuré avec la formule KBr. L'atome de potassium donne un électron à l'atome de brome, créant des particules chargées (ions) qui sont maintenues ensemble par une forte attraction électrostatique.
La clé pour comprendre le bromure de potassium est de le voir non pas comme un ensemble d'atomes, mais comme un réseau cristallin rigide d'ions potassium chargés positivement et d'ions bromure chargés négativement. Cette structure ionique est la source de ses propriétés et applications les plus importantes.

Les éléments constitutifs : l'histoire de deux éléments
L'existence du bromure de potassium est le résultat direct des propriétés chimiques fondamentales de ses deux éléments constitutifs. Chacun a un fort "désir" d'atteindre une configuration électronique plus stable.
Potassium (K) : Le métal alcalin
Le potassium est un métal mou, très réactif, que l'on trouve dans le groupe 1 du tableau périodique. Sa caractéristique principale est d'avoir un seul électron dans sa couche la plus externe.
Il est beaucoup plus stable énergétiquement s'il cède cet électron solitaire. Ce faisant, il devient un ion chargé positivement (K⁺).
Brome (Br) : L'halogène
Le brome est un non-métal réactif du groupe 17, les halogènes. Sa caractéristique principale est d'avoir sept électrons dans sa couche externe, soit un de moins qu'un ensemble complet et stable de huit.
Il accepte facilement un électron pour compléter cette couche, devenant un ion chargé négativement (Br⁻), connu sous le nom d'ion bromure.
Comment il est formé : La liaison ionique
La formation du bromure de potassium est un exemple classique de liaison ionique, qui se définit par le transfert, et non le partage, d'électrons.
Le transfert d'électrons
Lorsque le potassium métallique et le brome réagissent, chaque atome de potassium donne son unique électron externe à un atome de brome. Il ne s'agit pas d'un partage doux, mais d'un transfert complet.
Création d'ions chargés
Ce transfert d'électrons aboutit à deux particules stables, mais désormais chargées : le cation potassium (K⁺) et l'anion bromure (Br⁻). Comme les charges opposées s'attirent, elles sont puissamment attirées l'une vers l'autre.
Le réseau cristallin
Ces ions positifs et négatifs ne forment pas de simples paires. Au lieu de cela, ils s'organisent en un réseau tridimensionnel hautement ordonné et répétitif appelé réseau cristallin. Cette structure solide et rigide fait du bromure de potassium un solide cristallin blanc à température ambiante.
Comprendre ses propriétés et ses applications
La nature ionique du bromure de potassium explique directement son comportement physique et chimique, qui à son tour dicte ses utilisations.
Point de fusion élevé
Les puissantes forces électrostatiques qui maintiennent les ions K⁺ et Br⁻ ensemble dans le réseau cristallin nécessitent une énorme quantité d'énergie pour être rompues. C'est pourquoi le KBr est un solide avec un point de fusion élevé de 734 °C (1353 °F).
Solubilité dans l'eau
Bien que le réseau soit solide, il peut être brisé par des molécules polaires comme l'eau. Les molécules d'eau entourent les ions K⁺ et Br⁻ individuels, neutralisant leur charge et leur permettant de flotter librement, ce que nous percevons comme la dissolution du sel.
Utilisation en spectroscopie IR
Le réseau cristallin de KBr n'absorbe pas le rayonnement infrarouge. Cette transparence en fait un matériau idéal pour créer des fenêtres et des pastilles d'échantillons utilisées en spectroscopie IR, une technique qui aide les chimistes à identifier les molécules.
Utilisation en médecine vétérinaire
L'ion bromure (Br⁻) peut agir comme anticonvulsivant en interférant avec le transport des ions chlorure dans les neurones du système nerveux central. Pour cette raison, le KBr est utilisé en médecine vétérinaire pour contrôler les crises chez les chiens.
Pièges et risques courants
Bien qu'utile, le bromure de potassium n'est pas sans risques, qu'il est essentiel de comprendre dans ses applications pratiques.
Toxicité chez les chats
Le risque principal concerne l'utilisation vétérinaire. Le bromure de potassium est toxique pour les chats, provoquant une affection pulmonaire inflammatoire potentiellement mortelle. Il ne doit jamais leur être administré.
Toxicité du bromure (bromisme) chez les chiens
Même chez les chiens, où il est utilisé à des fins thérapeutiques, l'ion bromure peut s'accumuler dans le corps au fil du temps. Si les niveaux deviennent trop élevés, cela peut entraîner une affection appelée bromisme, avec des symptômes tels que faiblesse, tremblements et ataxie. Cela nécessite une gestion attentive de la dose et un suivi par un vétérinaire.
Comment appliquer ces connaissances
Votre perspective sur le bromure de potassium dépendra entièrement de votre objectif.
- Si votre objectif principal est la chimie : Considérez-le comme l'exemple typique d'une liaison ionique formée entre un métal alcalin du groupe 1 et un halogène du groupe 17.
- Si votre objectif principal est l'analyse en laboratoire : Reconnaissez que sa transparence IR et sa capacité à être pressé en pastille solide sont les propriétés clés qui le rendent inestimable pour la préparation d'échantillons.
- Si votre objectif principal est la santé vétérinaire : Comprenez que son effet thérapeutique provient de l'ion bromure, mais que cela est indissociable du risque grave de toxicité, en particulier chez les chats.
En fin de compte, savoir que le KBr est construit à partir d'ions transférés entre un métal et un non-métal est la base pour comprendre toutes ses utilisations et limitations.
Tableau récapitulatif :
| Aspect clé | Description |
|---|---|
| Formule chimique | KBr |
| Composition | Sel ionique de potassium (K⁺) et de brome (Br⁻) |
| Structure primaire | Réseau cristallin |
| Propriétés clés | Point de fusion élevé, soluble dans l'eau, transparent aux IR |
| Applications courantes | Préparation d'échantillons pour spectroscopie IR, anticonvulsivant vétérinaire pour chiens |
| Risque clé | Toxique pour les chats ; risque de bromisme chez les chiens en cas de dosage inapproprié |
Besoin de bromure de potassium de haute pureté pour votre laboratoire ou votre recherche ? KINTEK est spécialisé dans la fourniture d'équipements et de consommables de laboratoire de première qualité, y compris du KBr fiable pour la spectroscopie IR et d'autres applications. Nos produits garantissent la précision, la cohérence et la sécurité de votre travail. Contactez-nous dès aujourd'hui pour savoir comment nous pouvons répondre aux besoins de votre laboratoire avec les bons matériaux et l'expertise.
Guide Visuel
Produits associés
- Fabricant de pièces personnalisées en PTFE Téflon pour tige de récupération d'agitateur magnétique en PTFE
- Mouture de laboratoire avec pot et billes de broyage en alumine et zircone
- Moule de presse de laboratoire carré Assemble pour applications de laboratoire
- Homogénéisateur à cisaillement élevé pour applications pharmaceutiques et cosmétiques
- Presse Thermique Automatique de Laboratoire
Les gens demandent aussi
- Quelles sont les applications du molybdène ? Des fours à haute température aux lubrifiants spatiaux
- Comment les agitateurs magnétiques ou mécaniques affectent-ils l'efficacité de dégradation des PCO ? Optimiser le transfert de masse pour obtenir des résultats
- Quels sont les fluides frigorigènes les plus efficaces et les plus respectueux de l'environnement utilisés dans les ultracongélateurs ? Choisissez les hydrocarbures naturels pour un laboratoire plus écologique
- Pourquoi le revêtement par pulvérisation cathodique est-il utilisé pour la préparation des échantillons ? Prévenir la charge pour une imagerie MEB claire
- Comment l'évaporation se produit-elle dans les ultra-congélateurs ? Le processus fondamental de la congélation profonde
- Pourquoi la RF est-elle utilisée en pulvérisation cathodique ? Permettre le dépôt de couches minces sur des matériaux isolants
- Qu'est-ce que le frittage dans les semi-conducteurs ? Créer des contacts ohmiques fiables pour des puces haute performance
- Quelle est la différence entre l'isolat de CBD et le distillat ? Pureté vs. Effet d'entourage expliqué



















