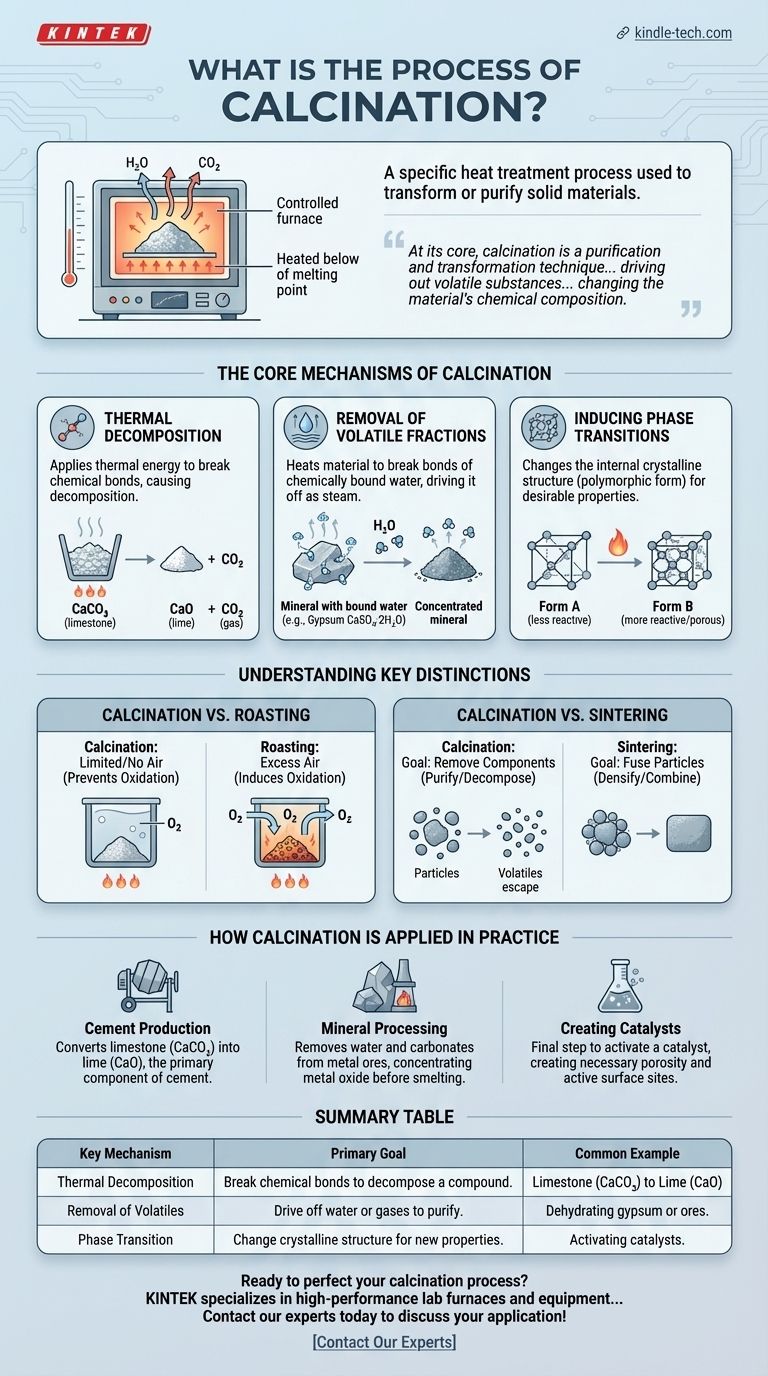
En science des matériaux et en métallurgie, la calcination est un traitement thermique spécifique utilisé pour transformer ou purifier des matériaux solides. Elle implique de chauffer une substance à haute température, mais en dessous de son point de fusion ou de vitrification, dans une atmosphère contrôlée qui présente un apport limité en air ou en est totalement dépourvue. Cette application précise de la chaleur est conçue pour provoquer une décomposition thermique ou éliminer les composants volatils tels que l'eau et le dioxyde de carbone.
À la base, la calcination est une technique de purification et de transformation. En appliquant soigneusement la chaleur en dessous du point de fusion d'un matériau, elle élimine les substances volatiles, modifiant fondamentalement la composition chimique du matériau et le préparant pour un traitement ultérieur.

Les mécanismes fondamentaux de la calcination
La calcination obtient ses résultats grâce à plusieurs changements physiques et chimiques distincts induits par la chaleur. L'objectif spécifique dicte quel mécanisme est le plus important pour une application donnée.
Décomposition thermique
C'est l'objectif le plus courant de la calcination. Le processus applique suffisamment d'énergie thermique pour rompre les liaisons chimiques au sein d'un composé, provoquant sa décomposition.
Un exemple classique est la production de chaux (oxyde de calcium) à partir de calcaire (carbonate de calcium). Lorsqu'il est chauffé, le carbonate de calcium se décompose, libérant du dioxyde de carbone gazeux et laissant derrière lui l'oxyde de calcium désiré.
Élimination des fractions volatiles
De nombreuses matières premières, en particulier les minéraux et les minerais, contiennent de l'eau chimiquement liée au sein de leur structure cristalline (hydrates).
La calcination chauffe suffisamment le matériau pour rompre ces liaisons et éliminer l'eau sous forme de vapeur. Cela élimine les impuretés et augmente la concentration de la substance désirée dans le minerai.
Induction de transitions de phase
La chaleur peut également être utilisée pour modifier la structure cristalline interne d'un matériau, un processus connu sous le nom de transition de phase.
Ceci est souvent fait pour convertir un matériau d'une forme polymorphe à une autre qui peut avoir des propriétés plus désirables, telles qu'une réactivité accrue ou une meilleure structure pour être utilisée comme catalyseur.
Comprendre les distinctions clés
Le terme « calcination » est souvent confondu avec d'autres processus thermiques. Comprendre les différences est essentiel pour saisir son objectif spécifique.
Calcination par rapport à la grillage
La différence clé réside dans l'atmosphère. La calcination se déroule en l'absence ou en quantité limitée d'air pour prévenir l'oxydation.
Le grillage, en revanche, est effectué avec un excès d'air spécifiquement pour induire l'oxydation. Il est souvent utilisé sur les minerais sulfurés pour les convertir en oxydes métalliques.
Calcination par rapport à la frittage
Ces processus ont des objectifs opposés. Le but de la calcination est d'éliminer des composants d'un matériau, le purifiant ou le décomposant efficacement.
Le frittage, cependant, utilise la chaleur pour fusionner de petites particules ensemble en une seule pièce solide, un processus connu sous le nom de densification. Il vise à combiner, non à retirer.
Comment la calcination est appliquée en pratique
Le choix d'utiliser la calcination est dicté par le produit final souhaité. Son application est fondamentale dans plusieurs industries majeures.
- Si votre objectif principal est la production de ciment : La calcination est l'étape essentielle pour convertir le calcaire (CaCO₃) en chaux (CaO), le composant principal du ciment.
- Si votre objectif principal est le traitement des minerais : La calcination est utilisée pour éliminer l'eau et les carbonates des minerais métalliques, concentrant l'oxyde métallique avant la fusion.
- Si votre objectif principal est la création de catalyseurs : La calcination est souvent l'étape finale pour activer un catalyseur, créant la porosité et les sites de surface actifs nécessaires.
En fin de compte, maîtriser la calcination revient à un contrôle thermique précis pour transformer une matière première en un produit raffiné et fonctionnel.
Tableau récapitulatif :
| Mécanisme clé | Objectif principal | Exemple courant |
|---|---|---|
| Décomposition thermique | Rupture des liaisons chimiques pour décomposer un composé. | Calcaire (CaCO₃) en Chaux (CaO) |
| Élimination des volatils | Éliminer l'eau ou les gaz (ex. : CO₂) pour purifier. | Déshydratation du gypse ou des minerais. |
| Transition de phase | Modifier la structure cristalline d'un matériau pour de nouvelles propriétés. | Activation des catalyseurs. |
Prêt à perfectionner votre processus de calcination ? KINTEK est spécialisé dans les fours de laboratoire haute performance et les équipements pour un traitement thermique précis. Que vous travailliez dans la production de ciment, le traitement des minerais ou le développement de catalyseurs, nos solutions garantissent le contrôle exact de la température et de l'atmosphère dont vous avez besoin pour des résultats supérieurs. Contactez nos experts dès aujourd'hui pour discuter de votre application !
Guide Visuel
Produits associés
- Four à moufle de 1700℃ pour laboratoire
- Four à moufle de 1800℃ pour laboratoire
- Four à moufle de four à étuve de 1400℃ pour laboratoire
- Four à moufle de laboratoire à moufle à levage par le bas
- Four rotatif à vide de laboratoire Four rotatif à tube
Les gens demandent aussi
- Quel est le mécanisme d'un four à moufle ? Maîtrisez un chauffage précis et sans contaminants
- De quoi sont généralement faits les fours ? Un guide des matériaux pour températures extrêmes
- Un four à moufle peut-il être utilisé pour la calcination ? Obtenir une décomposition thermique pure et contrôlée
- Quelles sont les règles de sécurité en laboratoire pour chauffer des substances ? Protocoles essentiels pour prévenir les accidents
- À quelle température la céramique fond-elle ? Un guide sur la résistance thermique de la céramique



















